Bio-Share | 抗体药物全面表征之理化属性分析
发布时间: Jul 14 , 2022
1976年单克隆抗体技术被Georges Köhler和 César Milstein发明,之后经历了鼠源、嵌合、人源化和全人源 4 个主要发展阶段,由于鼠源和嵌合单抗会产生人抗鼠抗体反应,所以人源化和全人源单抗已成为生物技术企业研发的主流。单抗的分子量高达 150 kDa 左右,结构复杂,其质控相比较于小分子药物要求更高。

以单抗技术为基础,又相继开发了抗体偶联药物、多特异性抗体药物、纳米抗体等多种新兴技术,如何全面表征抗体药物的关键质量属性,成为抗体药物开发的关键点和难点。本系列文章分为上下两篇,上篇重点是理化属性,集中在抗体药物结构、电荷及分子量大小变异体、糖异质性、工艺相关杂质、聚集体分析,下篇重点为活性分析,包括结合活性和生物学活性等。
理化属性表征
1. 抗体药物结构
抗体药物结构表征主要包括以下参数:
1) 完整分子量
2) 轻链分子量
3) 重链分子量
4) 氨基酸序列
5) 二硫键
6) 自由巯基
7) 糖基化位点
8) N-端测序
9) 翻译后修饰
10) 二、三级结构表征
在前9项一级结构表征中,LC/MS是最主要和最基础的表征方法,二三级结构涉及使用圆二色谱,红外光谱等,细节不作赘述。
抗体结构表征的目的,除了全面表征抗体药物质量,另外一个核心目标是寻找可能影响抗体药物疗效的关键氨基酸残基、关键氨基酸的翻译后修饰,进行相关工艺改造和确认,避免在工艺开发后期以及临床阶段,产生不良影响,也是本文主要的讨论内容,主要包括:脱酰胺,异构化,Met和Trp氧化,未配对的半胱氨酸等。
1.1 脱酰胺
天冬酰胺(Asn),尤其是CDR区的Asn残基脱酰胺,是单克隆抗体药物最常遇到的降解途径之一。当Asn后面是小的且活跃的甘氨酸(Gly)残基(NG基序)时,容易发生脱酰胺,并且如果发生在CDR区,会导致对抗原结合亲和力降低,抗体效力丧失。因而在抗体测序和生物信息学评估时,需要关注CDR区的Asn-Gly残基,并在强制降解阶段对其进行评估。
此外在IgG的Fc段“ PENNY”环肽中,也包含脱酰胺易感位点,但是因为通常不会对抗体药物结合抗原带来负面影响,一般不做重点关注。
1.2 氨基酸氧化
蛋氨酸(Met)和色氨酸(Trp)残基容易发生氧化。其中重链CDR2中的蛋氨酸以及Fc区中的蛋氨酸氧化并不会影响抗原结合。但是当氧化水平较高,或者发生在抗原结合的关键CDR区域,会降低抗原结合能力,降低抗体药物的有效性。
靠近CH2-CH3区域的蛋氨酸残基易发生氧化,导致热稳定性下降,聚集增加,补体依赖性细胞毒性(CDC)下降,与FcRn的结合亲和力下降以及体内半衰期缩短。
CDR中Trp残基的氧化,可能导致有效性降低,热稳定性降低和聚集倾向增加。
总体而言,生物信息学分析和一级序列测定时,应重点关注CDR区Met和Trp的氧化,并确定它们的敏感性,必要时在工艺阶段采取适度控制策略。
1.3 Asp异构化
Asp异构化是单克隆抗体药物的另一种降解途径。CDR区的Asp残基,如果后面是Gly残基,His或Ser时,通常易于异构化。CDR区发生异构化,可能导致抗原结合亲和力降低。当pH值在5左右时,有利于Asp异构化,因此抗体药物的制剂配方开发时,需要注意其pH值尽可能避开5。
1.4 糖基化位点
IgG CH2 Asn-297连接的N糖为核心7糖结构,四个N-乙酰葡糖胺(GlcNAc)和三个甘露糖(Mannose)残基。根据抗体的功能需要,会对抗体的糖型进行改造,以获取相应的功能特性,以及延长或缩短抗体半衰期等。因而糖基位点检测分析贯穿于抗体药物工艺的整个过程,也是质量放行的关键质量属性。
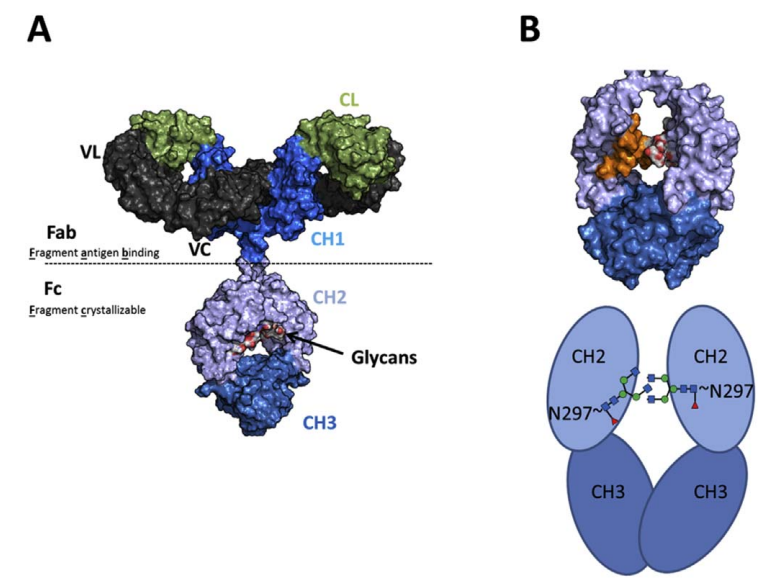
Biologicals (2017)
抗体糖工程改造主要有岩藻糖基化,乙酰葡糖胺化,半乳糖基化,唾液酸化四种。
通过核心岩藻糖基转移酶(Fut8)催化N-聚糖GlcNAc核心岩藻糖基化;通过乙酰葡糖胺基转
移酶3(GNT3)在分支角Mannose上添加乙酰葡糖胺(GlcNAc);通过β-1,4-半乳糖转移酶
1(b4GALT1)在七糖末端的两个GlcNAc添加半乳糖,使其半乳糖化。这三种策略是改变和1
型FcγR的结合。在核心岩藻糖基化以及半乳糖基化的基础上,在α2,6-唾液酸转移酶(ST6GAL1),可以增加抗体的唾液酸化,唾液酸化则可以增加和2型FcγR的结合。
糖异质性分析,通常使用LC/MS对于糖型进行鉴定,使用HILIC-FLD进行糖型定量分析,使用硼酸亲和色谱进行糖化检测。
1.5 未配对的半胱氨酸(Cys)残基
未配对的半胱氨酸会增加抗体的异质性,并可能对化学和热稳定、生物功能、聚体形成,抗原结合效力和蛋白折叠产生重大影响。单克隆抗体在CDR区可能具有未配对的半胱氨酸(Cys)残基,不过比较少见。未配对的Cys很容易地在细胞培养基中被游离的半胱氨酸修饰,会降低抗原结合亲和力。因此,未配对的半胱氨酸应视为质量属性进行常规监测和表征,以确保结构完整性和产品质量。
2. 变异体分析
重组抗体在培养工艺、纯化、制剂等阶段都容易引入抗体大小变异体和电荷变异体。抗体大小变异体和电荷变异体是抗体鉴别和一致性评价的重要指标。
大小变异体检测常用方法包括分子量排阻色谱,CE-SDS(2015版药典收录,2020版做了修订)。
抗体药物的电荷变化反映了各种蛋白质翻译后修饰的总和,对工艺改变的过程非常敏感,在整个开发过程中都需要密切监测,以确保一致性。常用的表征方法包括离子交换色谱法和等电聚焦法(2020版药典收录),检测指标包括等电点和酸碱变异体。
3. 聚集分析
抗体分子因为翻译后修饰、运输等的剪切力、杂质、pH值变化等引起蛋白质空间改变,形成空间互补、电荷互补,易产生聚集体。聚集体(或聚集颗粒)是最常见的产品相关的杂质。抗体聚集会增加抗体药物免疫原性,促进抗药物抗体产生,降低药物疗效,所以需要进行密切监控。
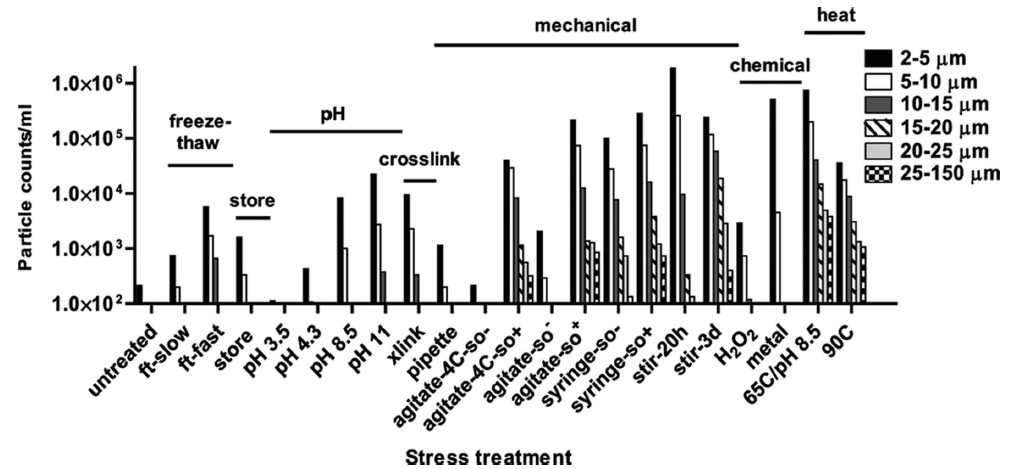
THE JOURNAL OF BIOLOGICAL CHEMISTRY 2011
常用的分析方法包括:十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)或毛细管电泳(CE-SDS),用于在变性条件下还原或非还原下测定mAb单体,片段和共价聚集体。体积排阻色谱法(SEC)也是确定单克隆抗体的高分子量聚集物(例如二聚体,三聚体或低聚物)的最常用方法。
对于大型聚集体(颗粒物),可以使用光散射来表征<1nm至1-10μm范围内的颗粒,比如常用的DLS方法,目前对于颗粒物,药典的检测方法包括光阻法(例如HIAC)和显微计数法。微流体成像技术,则被用于大于2-100μm的颗粒物,可以一定程度上区分蛋白质聚集颗粒物和其他异物。
4. 工艺相关杂质
工艺相关杂质,是指由生产工艺引入的杂质,主要包括宿主细胞残留的DNA和蛋白质,以及纯化时引入的蛋白A。宿主蛋白虽然不会引起严重的过敏反应等副作用,但确是工艺(尤其是纯化工艺)非常好的质控指标,所以一直是抗体药物表征的关键质量参数。
宿主DNA最常用的方法是定量PCR法,而宿主蛋白残留,一般推荐使用方法为ELISA法,但有时ELISA法的蛋白质覆盖度有不足,通常会结合使用质谱法和特定蛋白质的Western blot方法,以达到完整的覆盖。对于残留的蛋白A,通常使用ELISA法进行检测。
5. 一般属性
除去上述关键的质量参数,此外尚有pH值、渗透压、外观、粘度等指标用于表征抗体药物的一般属性,可以参考药典给出的标准方法进行测定。
小结
抗体药物因为分子量是小分子药物的数百倍,且因表达体系,工艺流程容易引入蛋白质翻译后修饰变化,大小变异体,电荷变异体,甚至会聚集形成颗粒等,对于质量表征提出了非常高的要求,本文分析了部分对于产品质量,尤其是会影响最终疗效的参数做了简要的梳理。

康日百奥分析实验室拥有Thermo Orbitrap Exactive HF-X液质联用仪,Thermo Vanquish UHPLC, Protein Simple Maurice, SCIEX PA800 plus, Waters ACQUITY H Class UPLC, Thermo CAD检测器, Malvern全自动毛细管差示扫描量热仪,Octet分子间相互作用仪,MD M5酶标仪,Roche480 qPCR仪等先进研究和检测设备,可对单克隆抗体,双抗,融合蛋白,ADC等生物药进行分析方法开发、确认和验证,并提供全面的蛋白表征研究(包含工艺可比性研究,生物类似药的相似性评价等)。,为抗体药物研发同仁提供优质的,可靠的服务。
主要参考资料
1. Xiaojie Yu et al,Improving Antibody-Based Cancer Therapeutics Through Glycan Engineering,BioDrugs DOI 10.1007/s40259-017-0223-8
2. Yingda Xu et al,Structure, heterogeneity and developability assessment of therapeutic antibodies,mAbs,2018
3. Cymer, F., Therapeutic monoclonal antibody N-glycosylation – Structure, function and therapeutic potential, Biologicals (2017), https://doi.org/10.1016/j.biologicals.2017.11.001
4. Classification and Characterization of Therapeutic Antibody Aggregates ,THE JOURNAL OF BIOLOGICAL CHEMISTRY VOL. 286, NO. 28, pp. 25118–25133, July 15, 2011
















