Bio-Share 细胞株构建 | 用于重组蛋白生产的CHO细胞系的历史回顾最新进展
发布时间: Apr 04 , 2023

用于重组蛋白生产的CHO细胞系的历史回顾最新进展
1957年,Puck分离出了中国仓鼠卵巢细胞(CHO细胞) 原始细胞系,此后CHO细胞在制药工业中被广泛应用于生产生物医学研究、诊断和不同治疗所需的重组蛋白。这些生物疗法,特别是单克隆抗体,在过去的几十年里已经显示出显著的市场增长,包括各种单克隆抗体(mAbs)、疫苗、激素和其他蛋白质等。
自2002年以来,FDA(美国食品和药物管理局)批准了300多种生物制品,这个数字仍在增长,如生物制剂(蛋白质、核酸、糖及其复合物)正进入越来越多的诊断和治疗领域。到2017年,市场上70%的生物制剂都是由中国仓鼠卵巢细胞(CHO细胞)产生的,其余的经批准的单克隆抗体主要使用了骨髓瘤细胞SP20 和NS0。CHO细胞作为生物制药蛋白生产中最常用和首选的宿主,主要基于CHO细胞的表达量很高(Batch培养可达0.1–1 g/L,fed-batch培养可达 1–10 g/L)且适合大规模工业培养,易于适应各种化学成分明确的培养基,不易受人类病毒感染,并且能够进行类似于人类的翻译后修饰。
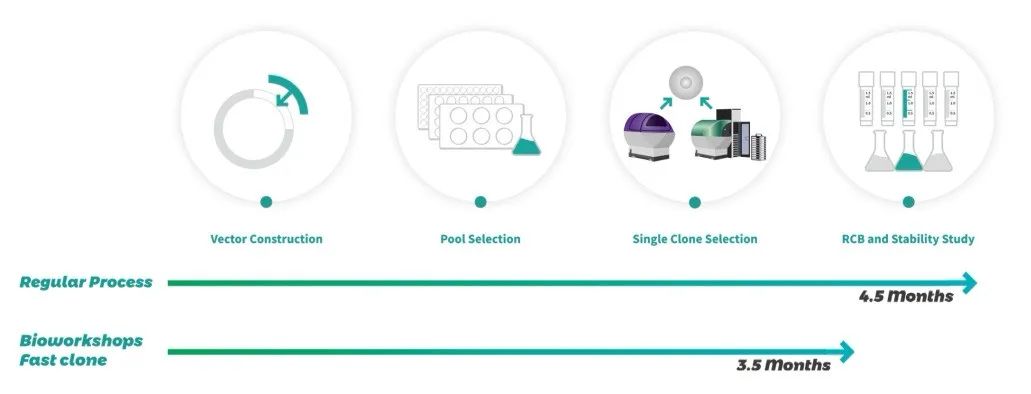
图1.康日百奥细胞株构建服务最快3.5个月交付
几十年来,世界各地的研究小组通过对CHO细胞突变或使其适应不同的培养条件,筛选出CHO细胞的亚克隆,进一步提高了CHO细胞系的性能。
CHO- k1,CHO DXB11, CHO- s和CHO DG44是使用最广泛几个的CHO细胞系。其中CHO DXB11 (dhfr+/-), CHO DG44 (dhfr-/-) 属于DHFR缺陷,通过甲氨蝶呤(MTX)进行筛选;CHO-GS-/- (CHO-K1SV)是基于谷氨酰胺合成酶介导的蛋氨酸亚砜亚胺(MSX)的筛选系统;CHO-S和衍生细胞系已适应悬浮培养,目的是通过增加生产者细胞密度来实现更高的容量生产。
CHO细胞都具有对遗传操作和不断变化的培养条件的良好适应性,这一特征使它们适合大规模的工业生产;但不利的一面是,这种细胞可塑性使CHO细胞具有更高的基因组重排倾向(缺失,易位),并成为生物生产过程中细胞系不稳定的来源。

图2. 康日百奥细胞株构建实验室
尝试对CHO细胞系进行改造的目的是实现更高的生产力和更好的产品产量。改造的主要策略是:提高有利于细胞增殖,延长细胞寿命,抗细胞应激,抗细胞凋亡,增加蛋白质生产能力和增强蛋白质分泌能力等相关的基因的表达水平。
大量研究表明,参与细胞代谢、蛋白质生物合成和糖基化的关键基因的短暂或稳定过表达分别提高了生长速度、生产力和更好的产品质量。多种抗凋亡转录因子(如BCL2、XIAP、AVEN、MCL1)的过表达也可提高细胞活力和培养性能。与强制表达有益基因相比,细胞系优化的其他方法侧重于通过基因组敲除或通过RNA介导的基因沉默来消除或抑制“不利”基因。通过靶向基因组操作部分或完全删除特定基因,也可以通过诱变关闭基因功能,或 siRNA介导的基因沉默。参与染色质重塑(如HDACs)和糖基化(如FUT8, SLC35C1)的基因也已成为敲除研究的目标,为了更好地操纵细胞系表达出具有特定翻译后修饰特征的重组蛋白。通过宿主细胞工程,可以实现CHO宿主衍生物的生成在生长、抗应力和生产力方面优于它们的亲本细胞系。工程生产细胞系已被证明能够达到3-7g/L的表达量。
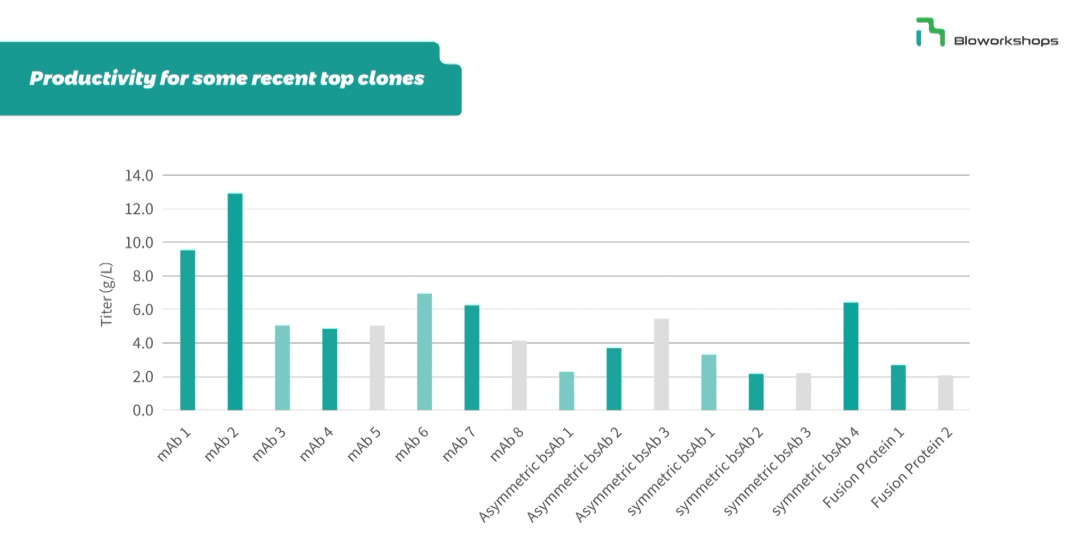
图3. 康日百奥已经交付多批次单抗、双抗、多抗等复杂蛋白项目
在重组细胞系的研究中,主要集中在使用靶向基因组整合技术进行表达优化。为了建立稳定的克隆细胞系,基因需要整合到宿主基因组中。传统的方法依赖于表达载体的随机整合,然后耗时地从具有异质的基因插入的重组细胞池中筛选合适的细胞。该方法存在两大缺点:整合效率低和整合位置不理想。通过不同的转座子系统(Sleeping Beauty、Leap-in、PiggyBac、Tol2)可以有效提高整合效率。普遍存在的染色质开放元件(Ubiquitous Chromatin opening Elements, UCOEs)以及其他调控基元已被用于防止基因沉默和维持高水平的表达。细菌人工染色体(BACs)也被用于确保转染后,整合基因的位点的独立性、稳定性和提高表达水平。

图4.康日百奥高通量单克隆筛选实验
对于一些难表达(DTE)的蛋白,Tadauchi等人进行了一项系统的研究,旨在了解是什么导致抗体表达困难。他们在确定的基因组整合位点构建了带有插入位点的模型细胞系,其中插入的转基因在(Tet/Dox)诱导启动子的控制下被驱动。该系统使表征蛋白的表达成为可能,这些蛋白可能是有毒的或由于任何原因难以表达。在具有代表性的研究中,Mathias等人跟踪了所选重组DTE蛋白在细胞合成过程中的加工过程,并研究了它们在分泌途径的各自细胞器中的分布。他们表明,在所选抗体的情况下,错误折叠是限制速率的步骤,也是阻碍分泌的原因,因为它会导致ER相关的分子降解。

图5. 康日百奥细胞株构建实验室
在细胞株开发过程中,除了重组细胞株表达量之外,产品质量对于生物治疗性蛋白质生产也是至关重要的,并且一直是工业技术开发工作的重点。对于目的蛋白的正确的翻译后修饰,特别是糖基化结构对于这些生物制剂的药效和药代动力学的影响。此外,糖基化(唾液酸,岩藻糖)的性质和数量,可能会影响生物制品的活性和安全性。
为了满足对蛋白产品日益增长的需求,并推动了制造工艺的不断创新。系统生物学方法为提高基于CHO的生物生产开辟了一个新的维度。基于基因组学,转录组学,蛋白质组学,代谢组学,脂质组学和糖组学等方面,为更好地描述和理解复杂的细胞功能提供了新的机会,从而为进一步优化的CHO细胞提供了基础。如何将这些知识应用到工业生物工艺优化和重组蛋白生产的开发中,仍然是一个挑战,需要在未来解决。
康日百奥细胞株构建业务

康日百奥Bioworkshops 以稳健的工艺交付了包含单克隆抗体,双特异性抗体(对称+非对称)、融合蛋白等的细胞株构建项目,伴随高表达,可放大性,良好的细胞株稳定性,进入到后续CMC开发阶段,并顺利通过美国,澳大利亚,中国的临床研究申请。不仅如此,康日百奥Bioworkshops也能在合作伙伴的Discovery阶段介入,利用CMC平台帮助进行候选分子的可开发性研究,缩短开发周期,减少项目CMC阶段开发的风险,以稳健的工艺,高效的生产将分子快速的推进临床。
双特异性抗体是治疗性抗体领域中极具创新性的一个版块,尽管这类分子的应用前景巨大,但由于存在双抗特异性的副产物(如错配,片段,高聚体等),也为这类分子的开发和生产带来了诸多挑战。因此,在这类产品开发的整个生命周期中,与拥有丰富双抗分子开发经验及专业知识的伙伴一起合作至关重要。康日百奥Bioworkshops 便是这样一位专注于克服复杂分子挑战的合作伙伴,致力于帮助客户推动创新双抗疗法的开发,为当前未满足的临床需求提供更多有效的治疗手段。
















