Bio-Share PC&PV | 生物制药制剂工艺表征的难点和解决方案
发布时间: Oct 22 , 2024
生物制药开发的目标是设计优质的产品和生产工艺,以始终如一的提供产品预期性能并同时满足患者需求。在生物制药产品开发路线图中,工艺表征已经成为不可缺少的一环,是关键性临床研究期间所进行的重要工作之一,也是注册申报监管审评中检查的重要内容。
我们不仅要把精力集中于上游细胞培养和下游纯化工艺的工艺表征时,也要注重制剂工艺的工艺表征。
制剂工艺表征也有“六步走”
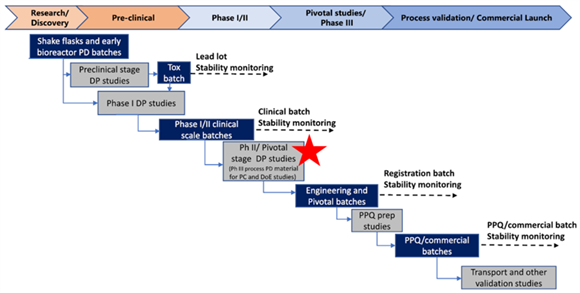
图1:生物制药制剂产品和工艺开发、表征和验证研究时间表和路线图。红色星号显示了制剂工艺表征的时间点和位置[1]
在之前的分享中,关于如何正确的准备和完成工艺表征研究,我们曾提出了完整且详细的工艺表征六步法步骤。详见六步浅谈工艺表征主要过程。
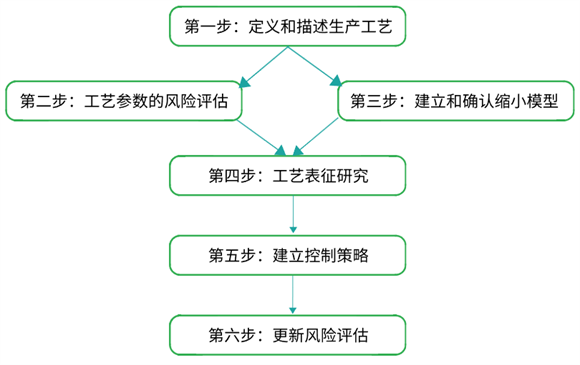
图2:工艺表征研究的六步法步骤
关于每一步的详细内容,康日百奥Bioworkshops(公众号)的系列文章已经为大家进行了总结,具体可查阅:
1. 六步浅谈工艺表征主要过程
2. 工艺表征中的质量风险管理
3. 缩小模型的建立和确认
4. 工艺表征研究的实验方法及案例
5. 工艺表征中CPP识别的进阶方法—实际显著性的应用
6. 建立控制策略
制剂工艺的工艺表征也可以应用相同的思路。可是,当把六步法思路应用于制剂工艺表征时,却发现其有自己独特的难点和挑战,导致难以直接实施。
结合实际的制剂工艺表征工作,我们发现难点主要存在于第三步,建立和确认缩小模型以及第四步,工艺表征研究中。下面章节我们将对这两个步骤的中的难点进行解析,并提出相应的解决方案。
制剂工艺表征缩小模型的难点和解决方案
建立和确认缩小模型的难点
制剂工艺表征,其本质也是基于风险评估和实验性研究来确定单元操作中输入变量(工艺参数和物料属性)对输出变量(工艺性能和产品质量)的影响。受限于材料的用量,在大规模上进行表征研究有些不切实际,因此需要使用缩小模型[2]。
缩小模型需要能够代表商业化规模的生产工艺,然而问题是,一些制剂单元操作,比如原液的冷冻和解冻、稀配混合和冻干工艺步骤,不能以线性方式成比例缩小,因此无法建立能够精确代表商业化规模工艺的缩小模型。
解决方案
关于该难点,Genentech曾提出一个解决方案,即使用部分缩小模型或最差条件缩小模型。在该概念中,建立的缩小模型只能用于研究单元操作的物理和/化学特性的特定子集,比如剪切力、细胞裂解、蛋白聚集等。因此,这种方法通常只能用于研究输入变量(工艺参数和物料属性)的极端最差条件,比较适合制剂工艺单元操作。下面展示了按照该思路建立的原液冷冻和解冻单元操作的缩小模型[3]。
在本示例中,原液的冷冻和解冻单元操作使用的是夹套金属浴以及配套的控温设备。在冷冻过程中,导热液体温度通常保持-55℃~-45℃,冷冻120L和300L的药物产品分别需要14h和18h,一旦冷冻完成,可以将冷冻设备拆除,夹套金属浴可移动至-25℃冷库保存。在解冻过程中,导热液体温度设定为22-25℃,解冻120L和300L药物产品分别需要9h和12h。使用蠕动泵从金属浴底部开始将已经融化的产品以缓慢流速(~1L/min)循环至容器顶部,为了减少液体飞溅,使用导流管来回流液体。一般解冻后4-5h即可开始混合循环操作,直至解冻结束[4]。
因为冻融过程的动力学取决于规模非依赖的工艺参数(比如导热温度、物质属性等),还取决于规模依赖的工艺参数(比如容器/药物体积比、传热表面积、再循环条件等),简单的缩小模型不能完全模拟大规模的冻融动力学,因此设计建立了最差条件缩小模型。
从工程原理分析,冷冻和解冻操作对原液的主要影响,一是源自冷冻和解冻速率的影响,快速冷冻/解冻或慢速冷冻/解冻均可能造成原液蛋白分子的剪切力。二是源自解冻过程中的混合和气液界面剪切力。
基于上述分析,设计20ml的微型不锈钢容器作为缩小模型,保持(1)容器/药物体积比和(2)空气/药物体积比。该模型可用于研究冷冻和解冻速率的最差条件。使用500ml的容器、软管和蠕动泵建立了解冻过程的缩小模型,可代表了解冻过程中混合和气液界面的最差条件。
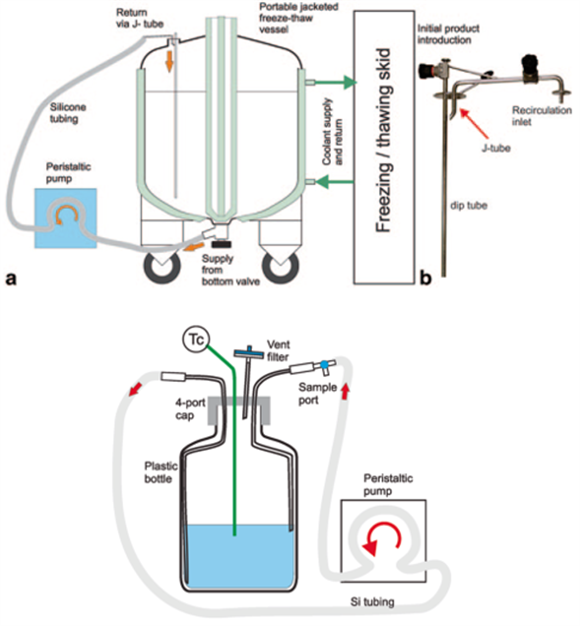
图3:原液冷冻和解冻步骤单元操作装置(上图)和建立的最差条件缩小模型(下图)[4]
在我们的分享文章“整合QbD的生物制药制剂开发新路线”中,还介绍了一个关于稀配混合单元操作的最差条件缩小模型的建立。详细内容可见微文链接[5]。
制剂工艺表征研究的难点和解决方案
制剂工艺表征研究的难点
制剂工艺表征实验研究的难点,很大程度的原因也是因为无法建立精确的,能够代表商业化生产工艺的缩小模型所致[6]。
因此,制剂工艺的工艺表征需要考虑实施一些特殊的实验设计。
制剂工艺表征研究的解决方案
- 基于最差条件实验设计的表征研究
正如上面原液冷冻和解冻的缩小模型示例,我们尝试建立了最差条件的缩小模型,那么就可以考虑在工艺表征实验设计中模拟该单元操作的最差条件来进行表征。对于原液冷冻来讲,最差条件则是最快和最慢的冷冻速率。
为了模拟快速冷冻区域,将1ml样品装入20ml摇瓶中,放入-40℃的冰箱的隔板上,可以在几分钟内降至-20℃。为了模拟缓慢冷冻该区域,将1ml样品装入20ml摇瓶中,放入冻干机中,开启一个缓慢降温程序,比如72h内降温至-40℃。模拟的这两个阶段冷冻速率已经超出了商业化生产规模的控制范围,因此代表了极端的最差条件。
冷冻完成后,在-20℃保存2h,然后进行解冻,对蛋白浓度、外观、浊度进行分析检测。
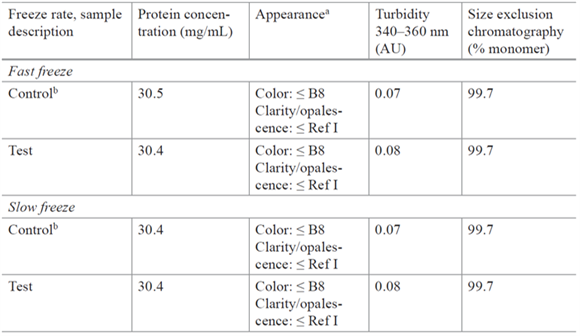
表1:快速冷冻和慢速冷冻表征研究中的产品质量[4]
- 基于商业化规模生产设备的确认运行进行表征研究
既然无法精确建立缩小模型,那么直接在商业化规模的生产设备上进行表征研究也是可以考虑的。商业化规模的生产设备的操作确认为该思路提供了机会。
比如冻干机的操作确认中可以建立输出变量的可接受操作范围。在冻干机的操作确认中可以进行搁板表面温度测温以确定冷点和热点以及确定最大和最小升温速率和降温速率[7]。
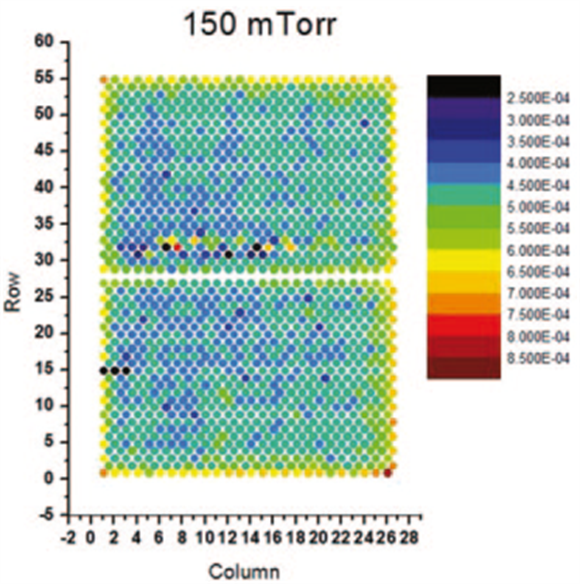
图4:冻干机的操作确认运行确定升温速率[7]
结果显示,冻干机可以实现最大1.5℃/min的升温和降温速率,然而跨越整个搁板的温度梯度能够达到的变温速率为1℃/min,因此,≤1℃/min的变温速率是预冻和干燥阶段的操作限度范围。
- 基于数学模型进行表征研究
基于冻干机设备、容器密封系统和处方的热量与传质特性开发了一个数学模型,可用于预测初级干燥阶段的产品温度与干燥时间。
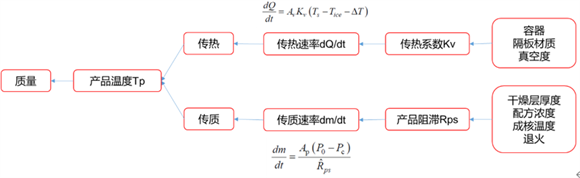
图5:冻干单元操作建立的数学模型[7]
基于该数学模型,可输入:
(1)搁板温度;
(2)冻干室真空度;
(3)描述传热系数与真空度相关性的参数;
(4)描述产品阻滞与干燥层厚度相关性的参数;
(5)药瓶内部和外部横截面面积;
(6)灌装体积;
(7)总固体数。
输出为初级干燥阶段的升华速率、最大产品温度与干燥时间。
总结
尽管生物制药的制剂工艺表征可以使用相同的思路和六步法策略,但是其仍具有特有的难点和挑战。这些难点和挑战主要存在于第三步,建立和确认缩小模型以及第四步,工艺表征研究中。本微文中介绍了这些难点和挑战,并同时提供了解决方案,以供大家参考。如果您在实际的制剂工艺表征中还存在有难点和挑战,可以咨询我们,康日百奥Bioworkshops作为一家专业的CDMO,可以提供完整而专业的工艺表征和工艺验证包,帮助客户更快,更高效的完成BLA申报和产品获批
参考文献
[1] Krishnan Sampathkumar, Bruce A. Kerwin, Road map for Drug Product Development and Manufacturing of Biologics, Journal of Pharmaceutical Sciences 000(2023) 1−18
[2] Martin–Moe S, Lim FJ, Wong RL et al (2011) A new roadmap for biopharmaceutical drug product development: integrating development, validation, and quality by design. J Pharm Sci 100:3031–3043
[3] Christian Hakemeyer, Process characterization and Design Space definition. Biologicals 44 (2016) 306-318
[4] Philippe Lam, Fredric J. Lim and Samir U. Sane, Drug Substance Frozen Storage and Thawing. AAPS Advances in the Pharmaceutical Sciences Series 18, DOI 10.1007/978-1-4939-2316-8_9
[5] Feroz Jameel and Sonja Wolfrum, A QbD Approach in the Development and Scale-Up of Mixing Processes. AAPS Advances in the Pharmaceutical Sciences Series 18, DOI 10.1007/978-1-4939-2316-8_9
[6] Alavattam Sreedhara, Rita L. Wong, Application of QbD Principles to Late-Stage Formulation Development for Biological Liquid Products. AAPS Advances in the Pharmaceutical Sciences Series 18, DOI 10.1007/978-1-4939-2316-8_7
[7] Sajal M. Patel, Feroz Jameel, Samir U. Sane and Madhav Kamat, Lyophilization Process Design and Development Using QbD Principles. AAPS Advances in the Pharmaceutical Sciences Series 18, DOI 10.1007/978-1-4939-2316-8_9
关于康日百奥Bioworkshops
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。
康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)
















