Bio-Share PC&PV | 生物制药混合单元操作的工艺表征研究
发布时间: Sep 24 , 2024
在生物制药的生产工艺中涉及两种不同类型的混合:单纯的混合、混合后分装/灌装;本文主要对两重混合的均一性研究进行了阐述。
两种不同类型的混合
在生物制药的生产工艺中涉及两种不同类型的混合:
单纯的混合
该种类型的混合涉及将不同的液体或粉末溶解到另一种溶液中。比如培养基/缓冲液的配制(液液混合和/或液固混合);工艺中间体样品的混合(通常为液液混合)。

图1:单纯混合类型,涉及液液混合或固体在液相中的溶解
混合后分装/灌装
该种类型的混合涉及在混合后并行发生分装或灌装步骤,比如原液混合后的过滤分装、制剂工艺中混合后的灌装操作等。

图2:混合后分装/灌装类型,涉及混合后的分装/灌装并行操作
单纯混合类型的均一性研究
单纯混合类型的均一性研究,与常规的合并和溶解操作类似,具有相似的研究方式和相似的结果决策标准[1]。
混合操作参数
单纯混合类型的均一性研究首先需要确定典型的混合操作参数,比如混合时间、混合设备每分钟转数(RPM)、传质系数(kLa)、单位体积功率(PPV)、温度等。这些操作参数的关键性取决于所混合的物料。温度和单位时间转速(RPM)通常选择设定点,而混合时间可选择最小值(考虑到混合程度),也应同时考虑选择最大值(考虑到剪切力、氧化等因素可能会带来产品降解)。
物料的选择
对于研究用的物料化合物,通常采用分组方法,即选择浓度最高或溶解度最低的化合物。在这些代表“最差条件”的物料化合物上的研究,通常可以代表其他物料化合物。
混合均一性研究方法
混合研究通常需要在指定的时间间隔从混合容器中取样、测定样品,然后将结果与混合时间作图。选择合适参数以加以识别与测量,例如,密度、电导率、蛋白质聚集、稳定性,或溶液澄清度(对于粉末而言),目视检查粉末是否完全溶解也可能是合适的。
此外,混合均一性研究方案中应包含所选检测参数的基本原理及其可接受标准。
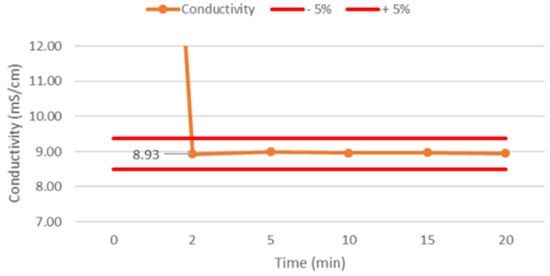
图3:使用替代模式溶液(5M氯化钠)加入纯化水中进行的混合均一性研究,电导率值为检测参数,可接受标准为测量值的±5%变化范围[2]
混合后分装/灌装类型的均一性研究
该类型的混合均一性研究要更加复杂一点,因为混合后的分装/灌装样品会影响制剂成品的含量等属性,进而影响临床的安全性和有效性。
总体来讲,该类型的混合均一性研究可采用相对标准偏差(RSD)方法或等价检验方法。
相对标准偏差(RSD)方法
最初,混合均一性研究的RSD方法来自于固体制剂的混合均一性和剂量单位均一性研究。2022年2月,CDE发布《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(试行)》提供了可参考的技术标准,用于指导化药口服固体制剂混合均匀度和中控剂量单位均匀度的研究[3]。
基于该指导原则,混合均一性通常采用分层取样方法,即从研究批次的各个确定位置选取单剂量样品,或者从生产过程的不同阶段或时期选取单剂量样品,取样点在覆盖全生产过程,可以在预设定的时间/位置间隔收集单剂量样品,也应选取可能造成成品含量均匀度不合格的高风险位点。
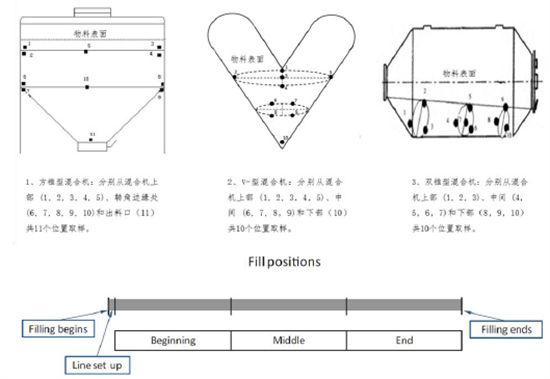
图4:分层取样方法示例
上部分为空间分层取样,下部分为时间分层取样方法[3]
研究结果的评估采用相对标准偏差(RSD)指标。比如,首先在整个批次中选取至少4-10个取样点,每个取样点至少取3份样品;每个取样点检测一个样品,计算所有样品的相对标准偏差(RSD)(n≥10),要求所有单值在均值的±10.0%(绝对)以内,并且RSD≤5%。

图5:分层取样和相对标准偏差(RSD)方法的混合均一性研究示例[2]
等价检验方法
相对标准偏差(RSD)方法要求检测参数的分析方法应当具有足够的准确度和精密度。如果分析方法的检测误差稍大,可考虑使用等价检验方法[4]。
等价检验采用相同的分层取样方法,不同是数据分析方法和可接受标准与RSD方法不同。
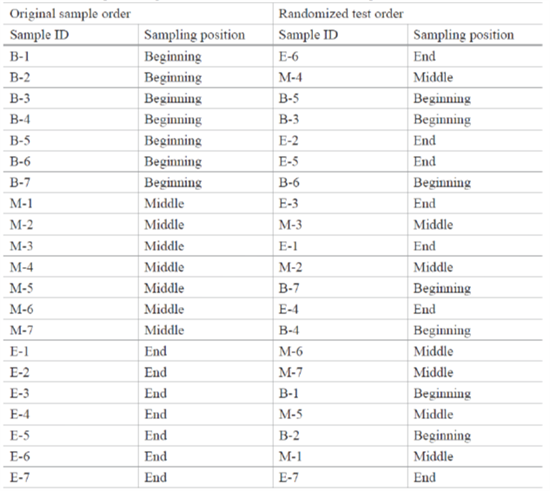
图6:混合均一性研究中的时间分层取样
等价检验是采用统计的双单侧T检验方法对不同分层取样的结果进行假设检验。等价检验需要提前设定等价区间。等价区间代表了分层样品结果之间无实际显著性差异的区间范围。比如使用分析检测方法误差的±3倍,作为等价区间。
本示例中,分析方法检测的是蛋白浓度,中间精密度为蛋白浓度的2%,目标蛋白浓度为50mg/ml,因此等价区间为:
±3x50mg/mlx2%=±3mg/ml
进而使用等价检验确定不同分层样品之间是否等价。结果显示,三个时间分层样品的检测结果之间没有显著性差异,因此证明了混合的均一性。
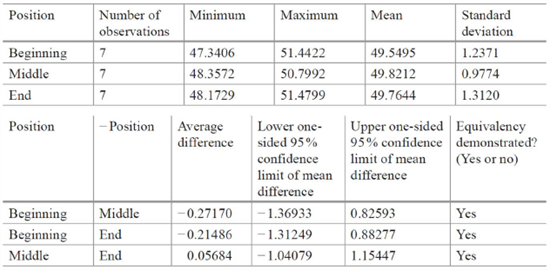
图7:示例的数据统计及等价检验结果总结
总结
生物制药生产工艺中可能会涉及两种不同类型的混合,单纯混合类型以及混合后分装/灌装类型。两种类型的混合均一性研究可能会采用不同的研究方式和决策策略,这取决于混合单元操作在生产工艺中的关键性和影响性。混合均一性研究是BLA监管注册申报中必须包含的重要内容。本文章对两种混合类型及其研究方法进行了总结,可以帮助读者思考和设计自己生产工艺中的混合均一性研究。
参考文献
[1] PDA Technical Report NO 60-3: Process Validation: A Lifecycle Approach Annex 2: Biopharmaceutical Drug Substances Manufacturing 2021[2] Dave Briggs, William Leonardi. Avid Case Study – Taking Your Molecule Through Process Validation. 2019[3] CDE《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(试行)》 2022年2月[4] Fuat Doymaz, Frank Ye and Richard K. Burdick. Chapter 26 Product Homogeneity Assessment During Validation of Biopharmaceutical Drug Product Manufacturing Processes. AAPS Advances in the Pharmaceutical Sciences Series 18, DOI 10.1007/978-1-4939-2316-8_26
关于康日百奥Bioworkshops
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。
康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)
















