Bio-Share PC&PV | 生物制药工艺表征研究的加速策略总结
发布时间: Aug 20 , 2024
尽管生物制药的工艺开发已经相对成熟,但传统上,从用于产生细胞系的DNA到提交生物制药上市许可申请(BLA)的整个产品和工艺开发仍需要10-15年的时间[1]。不过,这一趋势正逐渐的被“加速时间表”所替代。
生物制药的加速时间表
生物制药的早期工艺开发的工作包括细胞系生成、先导克隆选择、细胞库的构建,以及符合药品生产管理规范 (GMP) 的FIH 活动以及早期工艺的定义或锁定。传统的早期工艺开发,即从DNA到IND的时间表为12-16个月[2]。采用多种不同的策略,包括稳健的细胞培养平台,用于细胞株开发的定点整合,以及使用非单克隆库进行毒理学 (Tox) 研究样品的生产,可以将传统时间表(12-16个月)缩短为大约4-6个月[3]。
生物制药的后期工艺开发的工作包括进一步的工艺开发、工艺表征和工艺控制策略的开发。与早期工艺开发相比,其主要目标是提高上游表达滴度和下游纯化收率、提高工艺稳健性、扩大生产规模以生产商业化的原液和制剂,同时保持可比的产品质量概况。传统的后期工艺开发时间表需要10-15年,而加速时间表则可以缩短至2-4年。
后期工艺开发中的工艺表征(PC)和工艺性能确认(PPQ)是BLA的监管要求。传统来讲,从商业化工艺锁定开始PC研究到启动PPQ活动通常需要12个月的时间。而在BMS的一篇报道中,通过采取各种策略将工艺表征研究的时间缩短至4个月[4]。
需要解释的是,在BMS的报道中,缩短的时间表特指上游工艺表征活动,不过同样的思路和策略也适用于下游和制剂的工艺表征以及处方表征。本篇文章并非强调如何在4个月内完成工艺表征的研究,而是基于该报道,思考和总结那些可以加速生物制药工艺表征研究的策略。
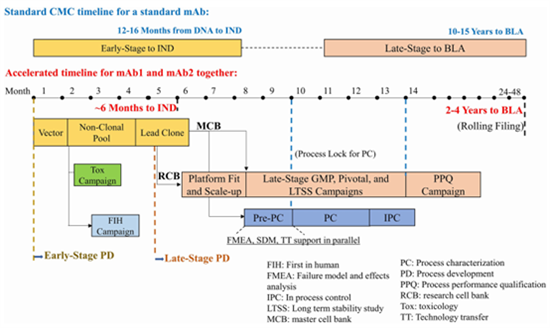
图1:BMS报道的单克隆抗体药物传统和加速开发时间表
工艺表征的步骤和加速策略
工艺表征是后期工艺开发中的重要活动。工艺表征研究是利用风险评估和实验性研究来确定工艺输入变量(工艺参数和物料属性)对工艺输出变量(工艺性能和产品质量)的影响的一系列研究。工艺表征研究中捕获的工艺知识与理解以及基于此建立的控制策略将是工艺验证阶段2(工艺性能确认)的输入[5]。
关于如何正确的准备和完成工艺表征研究,我们曾提出了完整且详细的工艺表征六步法步骤,主要步骤内容如下:
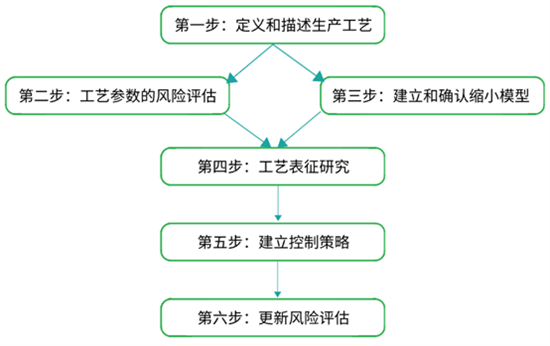
图2:工艺表征研究的六步法步骤
关于每一步的详细内容,康日百奥Bioworkshops(公众号)的系列文章已经为大家进行了总结,具体可查阅:
随着工艺表征工作的成熟和规范,其中的每一步中的都可以采用一些策略来加速。下面将总结我们在工艺表征中采用的加速策略,当然这些策略都不会牺牲对工艺知识和产品知识的捕获与理解。
定义和描述生产工艺中的加速策略
定义和描述生产工艺,即对生产工艺中每一个单元操作的详细说明,包括单元操作的输入变量及其可接受范围,以及单元操作的CQA及其可接受范围。工艺描述、工艺流程图以及鱼骨图等工具可用于定义和描述生产工艺。
定义和描述生产工艺是后续工艺表征的基础。如果加速该步骤,知识管理是非常重要的策略。知识管理是一种策略性和系统性的方法,包括在所有工艺和产品开发活动中,对所有工艺步骤数据的采集、分析以及获得的产品和工艺信息与知识的受控保存和传递。
诺华曾报道将所有包含最新外部和内部公司信息的信息源,比如源自现有的先验知识和文献、项目特定知识、稳定性数据、临床和非临床数据以及通过对待开发产品的深入分析获得的表征数据等,进行简化和标准化以及总结和汇编。这些知识不但有助于定义和描述特定产品的生产工艺,而且可供后续的关键质量属性、关键工艺参数和关键物料属性的风险评估使用。这种知识的可用性简化了风险评估同时也大大增加了风险评估过程的一致性[6]。
工艺参数风险评估的加速策略
工艺参数的风险评估主要用于筛选出高风险的输入变量,以纳入后续的工艺表征实验研究。通常使用的工具是风险评估工具,比如因果效应矩阵(C&E)、失败模式与效应分析(FMEA)以及风险排序与过滤(RRF)等。
实际执行工艺参数风险评估时,总会带有一定的主观性和模糊性。这主要是因为
(1)评估过程中工艺参数的范围以及工艺参数对输出属性的影响程度定义不明确;
(2)开发过程中收集的特定知识受限引起。
加速工艺参数的风险评估,则需要解决风险评估过程中的主观性和模糊性。基于此,GSK提出了相应的解决方案[7]。
控制范围与Delta范围
针对评估过程中工艺参数的范围以及工艺参数对输出属性的影响程度定义不明确问题,GSK首先通过收集实际生产过程中的数据,定义特定单元操作背景下工艺参数实际变化的范围(控制范围)以及输出属性的变化范围(Delta范围)。
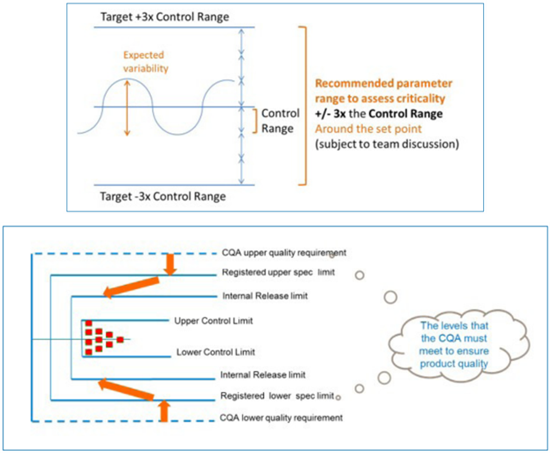
图3:定义实际生产过程中的工艺参数范围和输出属性范围
实际评估过程中,工艺参数的评估范围将设定为控制范围的倍数,比如3倍。工艺参数对输出属性的影响,则设定为在工艺参数的评估范围内,输出属性变化范围相对于Delta范围的变化。
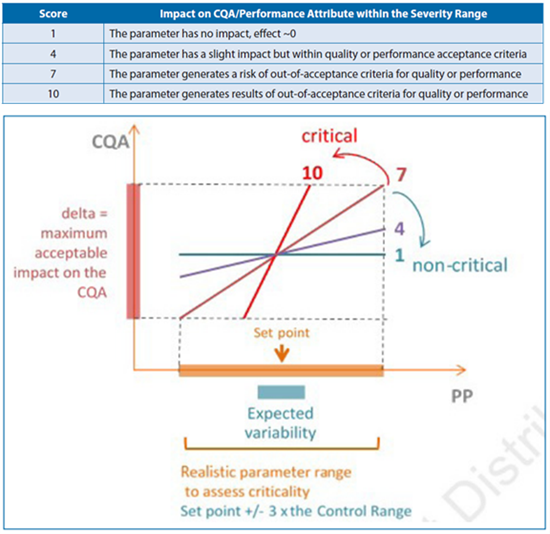
图4:工艺参数对输出属性影响程度的定义
不确定性评分
针对开发过程中收集的特定知识受限问题,GSK在工艺参数的风险评估过程中增加了不确定性评分,这样在知识有限的情况下可系统性的提高影响性评分,从而降低评估过程中的模糊性。这种做法在Genentech报道的工艺表征的参数风险评估工具(风险排序与过滤,RRF)中也曾使用。
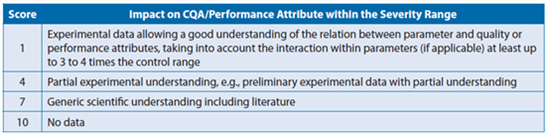
图5:GSK使用的不确定性评分标准
缩小模型建立和确认的加速策略
由于在生产规模上进行PC研究实际上不可行,因此需要开发能够代表商业化生产工艺的缩小模型。缩小模型的建立和确认对于获得可靠的PC结果至关重要。为了最大限度的加速缩小模型的建立,可以考虑进行缩小模型开发的筛选实验,尤其是对于具有规模效应的细胞培养步骤。加速缩小模型的确认的策略,则可以考虑回顾性确认或者使用确认的分层策略。
缩小模型建立的加速
在初步的建立的缩小模型上进行单因子的筛选实验,尤其是涉及规模相关的工艺参数时,比如搅拌速率、表通气速率和低通气速率。单因子实验快速确定了最合适的缩小模型操作条件,减少了缩小模型确认过程发生不可比的风险。
BMS报道的缩小模型建立过程中进行的单因子筛选实验,最后确定了最合适的缩小模型的搅拌速度、表通气速率和低通气速率[8]。
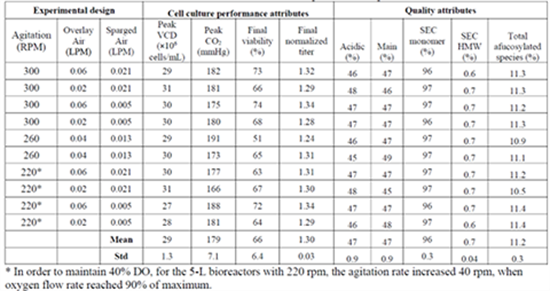
图6:BMS报道的缩小模型建立的单因子筛选实验
缩小模型确认的加速
BMS在缩小模型确认过程中的加速策略包括采用分层(两层)确认策略和回顾性确认策略。
两层确认策略是指首先使用等价性检验(TOST)进行确认。等价性检验的等价标准选择生产规模数据的±3倍标准差。如果等价性检验失败,则考虑实际意义的等价性评估作为第二层确认标准。实际意义的等价性评估使用产品质量标准限值的20%或分析方法(设备)的变异性作为确认标准[8]。
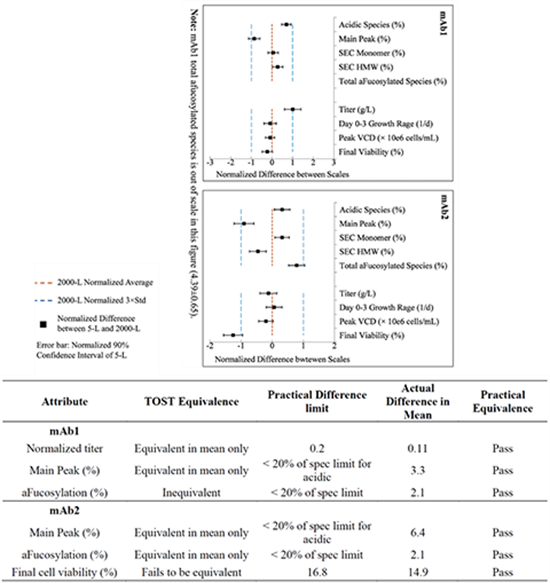
图7:BMS使用分层(两层)确认策略进行两个单抗产品(mAb1和mAb2)缩小模型的确认
上部分为等价性检验,下部分使用实际意义的等价性评估
此外,如果进行了缩小模型的筛选实验以及分层确认策略,BMS认为采用回顾性的缩小模型确认策略,其风险也是可以接受的。回顾性确认的确可以节省大量的时间,加快了进入PC研究的速度。
工艺表征研究中的加速策略
工艺表征实验研究常采用单因子实验或者实验设计(DoE)的方法。监管机构鼓励使用DoE方法,不仅仅是因为DoE能够解析更多的输入因子的主效应和因子之间的交互效应或二次项效应,同时也是因为DoE所需的实验数量更少(相对于多个单因素实验)。
更科学的应用DoE,可以帮助加速工艺表征的实验研究。海正博锐发表的文献中,报道了使用确定性筛选设计(DSD)进行上游细胞培养工艺表征的案例。该案例中表征了5个细胞培养工艺参数,实验设计只需要了13次实验,不仅仅可以解析工艺参数主效应,同时可以解析二阶交互效应和二次项效应。一步到位的建立了回归方程并获得了工艺参数的设计空间[9]。
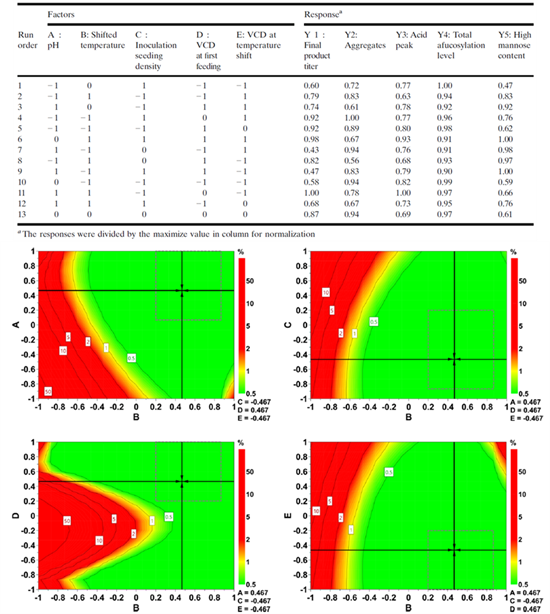
图8:上游细胞培养的工艺表征研究(确定性筛选设计)
上图为确定性筛选设计的实验许选点。下图为基于确定性筛选确定的设计空间。
基于DoE设计的基本原理,还可以考虑其他加速策略,比如DoE设计的序贯策略,定制DoE设计等。众多而灵活的DoE设计为PC研究的加速提供了更多的选择。
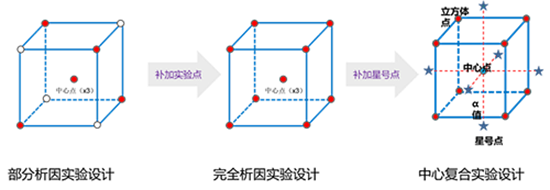
图9:序贯DoE设计策略
从部分析因DoE到完全析因DoE,再到中心复合DoE,前面已经执行过的实验将与补加的实验组合在一起,共同组成一个完整的设计。
除了DoE设计,数据建模技术的发展也为PC研究提供了一种加速策略。经典的建模技术包括数据建模、机理建模和综合数据与机理的混合建模。机理/混合模型不需要太多的初始数据,而且可以实现数据模型所不具有的外推功能。因此,机理模型可以用来模拟更多的实验场景,从而实现在计算机上的工艺参数甚至是物料属性的研究,大大减少了实验次数。
建立控制策略的加速策略
工艺控制策略是一组有计划的控制,源自当前的产品和工艺理解,可确保一致的工艺性能和产品质量。从PC研究中获得的工艺控制策略(例如,参数关键性、设定点和范围)对于定义允许的操作非常重要,这也是监管机构在提交BLA之前的要求。
BMS报道中,可以通过建立PC研究备忘录,并以此为基础建立工艺控制策略,以及滚动编写工艺控制策略的方法来加速工艺控制策略的建立。滚动编写策略是指,比如培养基制备的控制策略和生产批记录 (MBR) 是在车间GMP培养基制备之前编写和批准的,而用于细胞复苏和接种扩增步骤的控制策略MBR则在之后获得批准。因此,种子和生产生物反应器的控制策略和MBR在PPQ启动后具有更大的灵活性来编写和批准[8]。
其他加速策略
除了上述总结的适用于工艺表征各步骤的加速策略外,还有一些其他加速策略可考虑:
- 充分利用平台知识、其他项目经验和知识来降低工艺风险,减少PC研究的内容,从而将PC研究集中在最重要、高风险的工艺步骤和工艺参数上,而细胞复苏、摇瓶种子扩增等低风险步骤将不再纳入PC研究[8]。
- 卫星罐运行:使用商业化规模生产的卫星罐运行策略进行PC研究,这样可以利用GMP生产中培养基和种子培养物,从而节省实验室PC研究的资源和时间[8]。
- 最差条件链接研究:将一些确认性的最差条件的链接研究移动到PPQ之后进行,因为这些不是工艺控制策略和MBR制定所必须的[8]。
总结
随着FDA工艺验证生命周期方法的完善,工艺表征研究已经成为工艺验证不可或缺的内容。我们常想如何在不影响产品质量的前体下,加速工艺表征的进展,而同时不会牺牲获取的信息和知识。本文中介绍的多种加速策略便可帮助实现该目标。BMS报道已通过这些加速策略(部分)实现PC研究缩短至4个月。也许每个项目会稍有所不同,但是考虑使用这些加速策略总将会有所助益。
参考文献
[1] How long a new drug takes to go through clinical trials. Cancer Research UK; 2019.
[2] Kelley B. Developing therapeutic monoclonal antibodies at pandemic pace. Nat Biotechnol. 2020;38(5):540–45. doi:10.1038/s41587-020-0512-5.
[3] Zhang Z, Chen J, Wang J, Gao Q, Ma Z, Xu S, et al. Reshaping cell line development and CMC strategy for fast responses to pandemic outbreak. Biotechnol Prog. 2021;n/a:e3186.
[4] Hakemeyer C, McKnight N, John RS, Meier S, Trexler-Schmidt M, Kelley B, Zettl F, Puskeiler R, Kleinjans A, Lim F, et al. Process characterization and design space definition. Biologicals. 2016;44 (5):306–18. doi:10.1016/j.biologicals.2016.06.004.
[5] PDA Technical Report NO 60:Process Validation: A Lifecycle Approach, 2013年
[6] Gerald Gellermann, Christoph Rösli, Critical Quality Attribute Assessment and Definition of Acceptable Limits for IgG1 Monoclonal Antibodies © 2021 Parenteral Drug Association, Inc.
[7] Geoffroy Geldhof, Alessandro Pieri, Annick Vandercammen, Approach to Speeding Up Process Understanding Without Compromising on Quality: A Vaccine Case Study © 2021 Parenteral Drug Association, Inc.
[8] Jianlin Xu, Jianfa Ou, Kyle P. McHugh, Michael C. Borys & Anurag Khetan, Upstream cell culture process characterization and in-process control strategy development at pandemic speed. MABS 2022, VOL. 14, NO. 1, https://doi.org/10.1080/19420862.2022.2060724
[9] Lei Nie, Dong Gao, Haiyan Jiang, et al. Development and Qualification of a Scale-Down Mammalian Cell Culture Model and Application in Design Space Development by Definitive Screening Design. AAPS PharmSciTech (2019) 20:246 DOI: 10.1208/s12249-019-1451-7
[10] GoSilico网页公开信息,https://gosilico.com/technology/mechanistic-models/.
关于康日百奥Bioworkshops
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。
康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)
















