Bio-Share PC&PV | 物料变异性研究的行业实践之关键物料属性
发布时间: Jul 08 , 2024

生物制药具有复杂的非线性特性,充满了各种可能影响药物安全性和有效性的工艺变异性。近几年,制药行业引入了工艺表征和实验设计(DoE)等概念,对工艺变异性进行了深入的研究并获得了相当的知识。然而,却独独忽略了物料的变异性[1]。
生物药中物料的变异性
物料已经开始成为生物制药工艺性能和产品质量变异性的主要来源。物料的变异性来自于其材料的化学或物理特性的变化。这些变异性会影响工艺特性和产品质量(比如层析介质的批间一致性导致工艺收率和产品质量的意外变化),会影响产品的安全性、有效性和稳定性(比如聚山梨酯 的氧化影响产品的稳定性),有时,甚至会导致重大的不良事件,包括药品的召回(比如药品容器中的玻璃颗粒在过去几年中导致了20多起产品召回)[2,3]。
基于属性的物料变异性研究
针对物料的变异性,ICH Q7指南描述了现行做法。指南指出,用于生产原料药和制剂的物料需要在收到时确认其鉴别,并要求供应商提供分析检测证书(COA)[4]。制药企业可以通过审计供应商、年度审计计划以及物料的测试来确定物料的合规性。可是,生物制药工艺中的物料数量相对较多(可能会超过100种),这就带来了物料研究和控制的挑战。
为了有效率的研究大量的物料,提出了基于属性的物料变异性研究方法,这来自于质量源于设计的理念[5]。该方法的重点是确定物料的关键物料属性(CMA),从而实现稳健的物料控制策略。
物料属性是指物料的特定物理、化学、生物或微生物特性或特征,而关键物料属性则是指物料的物料属性中能够影响药物安全性、有效性和质量等方面的特性。ICH Q8“药物开发”中要求识别和控制影响关键质量属性(CQA)的关键工艺参数(CPP)和关键物料属性(CMA)。
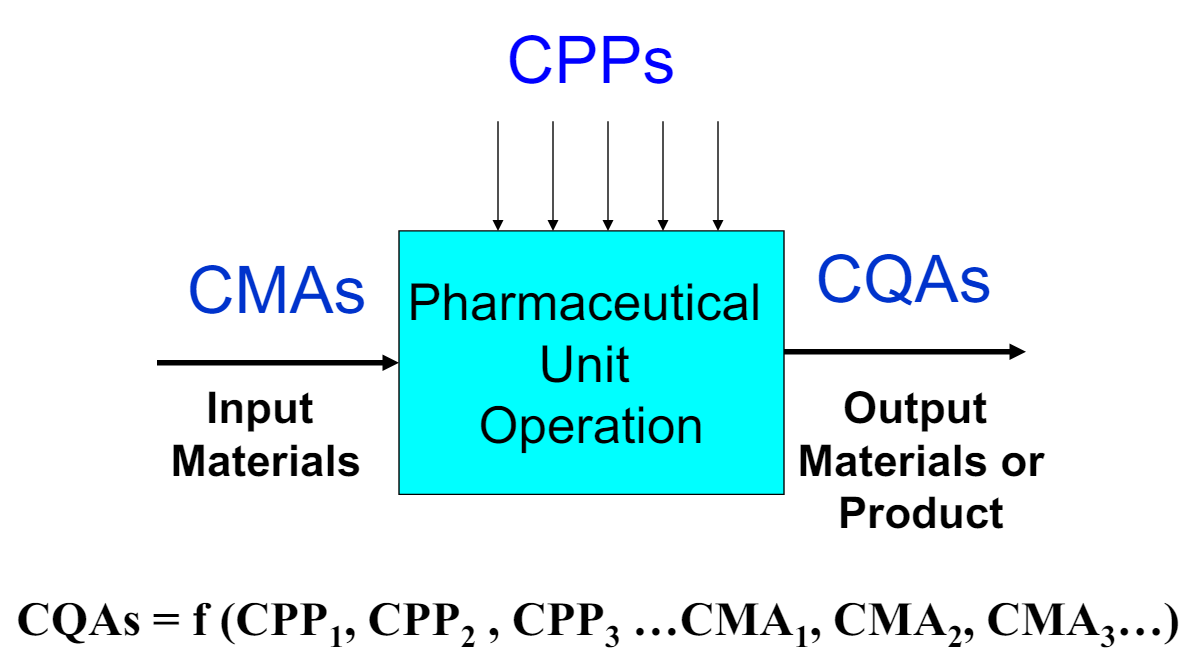
图1:CMAs、CPPs与CQAs之间的关系[6]
关键物料属性研究的方法步骤与关键工艺参数研究基本相同,可包含:
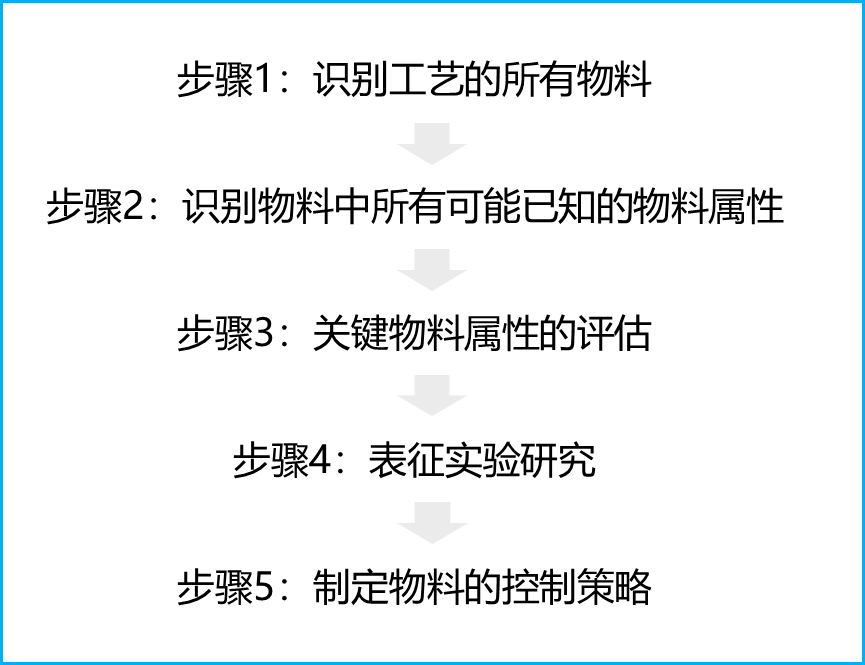
图2:关键物料属性研究的方法步骤
步骤1:识别工艺中的所有物料
识别工艺中的所有物料,以及它们的用途和在生产工艺中的位置。
生物制药生产中使用的物料多种多样,包括用于细胞培养和发酵的培养基、用于下游纯化的各种试剂和化学品以及用于最终制剂处方的赋形剂。物料还包括各种产品接触材料(耗材),比如一次性袋子、容器密封系统等。
步骤2:识别物料中所有可能已知的物料属性
可以通过早期供应商筛选提供的资料和信息、供应商审计、物料放行检测证书以及相关的药典法规要求来识别物料的物料属性。
典型的物料属性可包括物理属性(比如颗粒形态与粒径分布、多态性、溶解度、水分含量和吸湿性等)、化学属性(比如纯度、pKa、残留溶剂、重金属含量以及在固态和溶液中的化学稳定性等)和生物属性(比如微生物限度、内毒素、生物活性等)。除此之外,还需要考虑的物料属性包括批次一致性、来源和历史以及特定生物标志物等。
识别所有的物料属性后还应考虑其相关的分析检测方法,这将有助于下一步骤中对物料属性进行的风险评估。
步骤3:关键物料属性的评估
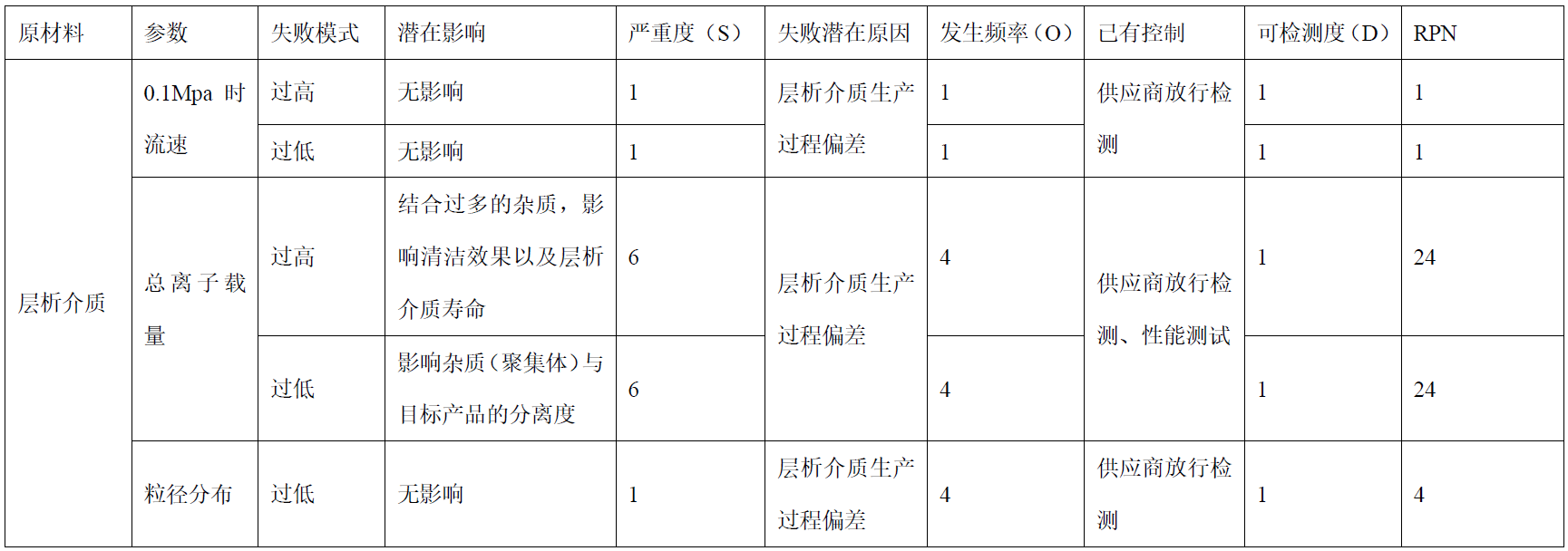
可使用质量风险管理工具对物料属性进行风险评估,比如因果效应矩阵分析(C&E)、失败模式与效应分析(FMEA)。
FMEA可在三个维度上对物料属性进行评估:
- 严重度(物料属性失败对工艺性能和产品质量的影响程度)
- 发生频率(物料属性失败的发生概率)
- 可检测性(物料属性失败的检测情况),风险顺序数(严重度x发生频率x可检测性)可用来确定高风险或潜在的关键物料属性
PDA技术报告81“细胞治疗产品控制策略”中提出了一个对物料属性进行风险评估的FMEA工具[7]。
表1:层析介质物料属性的FMEA评估示例
步骤4:表征实验研究
步骤3评估出的高风险或潜在关键物料属性应当纳入工艺表征研究中。这可以跟高风险或潜在关键工艺参数的表征研究同步进行。
只是,关键物料属性的表征研究在选择代表性的物料时需要谨慎。比如FMEA风险评估确定总离子载量为潜在关键物料属性,那么当纳入该属性进行表征实验研究时,选择进行实验的层析介质应当是该物料属性(总离子载量)差异较大的两个批次,并且在研究中将该物料属性作为一个因子进行实验设计。
《A-Mab Case Study》中对阳离子交换层析步骤的表征研究中,就选择了低和高总离子载量的两批次层析介质,以此设计实验来表征该物料属性对工艺性能(收率)和产品质量(聚集体、HCP去除)的影响[8]。
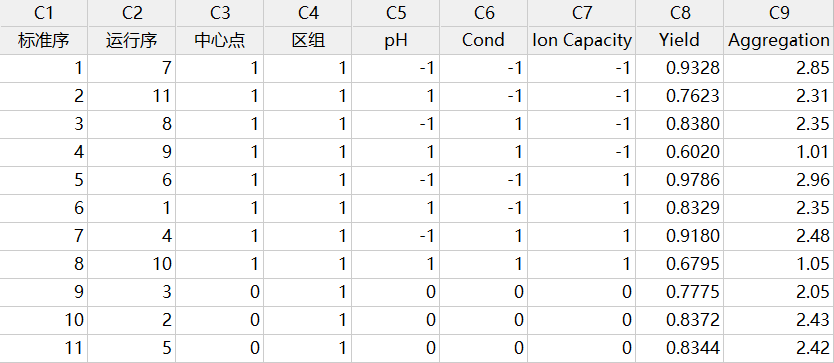
图3:一个包含物料属性(层析介质总离子载量)的
实验设计(DoE)
执行实验设计以及对结果数据进行分析,可能会显示出:
- 表征的物料属性对工艺性能和产品质量无统计显著性影响,那么该物料属性将分类为非关键物料属性,而该物料也将分类为非关键物料
- 表征的物料属性对工艺性能和产品质量具有统计显著性影响,同时也具有实际意义显著性影响,那么该物料属性将分类为关键物料属性,而该物料也将分类为关键物料
步骤5:制定物料的控制策略
对于非关键物料和非关键物料属性,可以通过制药企业内部质量体系进行管理,比如进行供应商审计、要求供应商提供放行检测证书、进行企业内部放行检测等,与传统的制药生产用物料的控制一致。
如果将设定为关键物料,则可能需要考虑更多的控制策略,比如稳健工艺策略。稳健工艺策略是利用步骤4的表征实验研究结果来制定控制策略。在该策略中,物料将被视为生产中的“不可控因子”,我们通过寻找和调整其他“可控因子”的水平,比如pH和电导,而使得物料对工艺性能和产品质量的影响最小化。稳健工艺策略是此种情形下最优的物料控制策略。
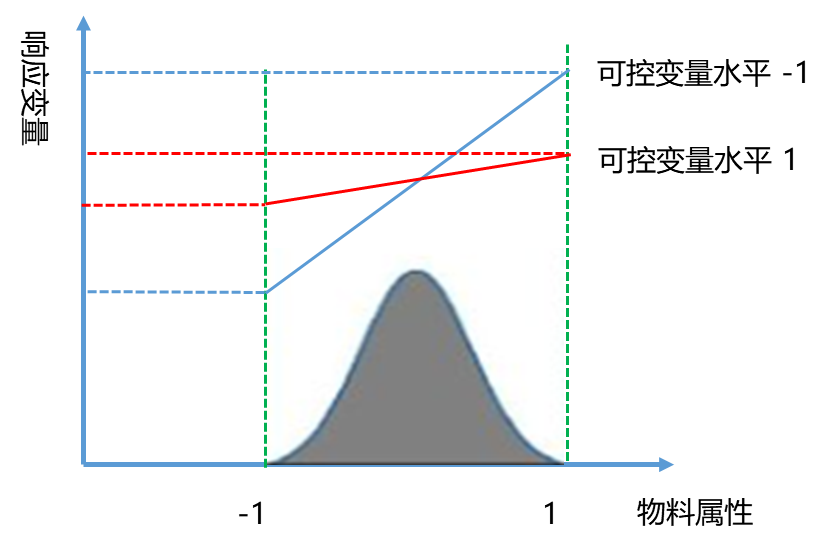
图4:稳健工艺策略示意图
除了稳健工艺策略之外,还可以考虑的控制策略有:
- 定制物料(要求物料的物料属性水平在可接受的范围内)
- 混合不同批次物料(混合批次可降低物料属性的变异性)
这些策略并非最优策略,在选择使用时需要谨慎。
总结
对于生物制药,物料的变异性最优选择在产品和工艺开发的早期阶段进行解决。如果在产品和工艺开发的后期才发现,这将是一件“不幸”的事情,这意味着可能需要进行工艺变更或者工艺控制策略的改变。对物料的物料属性进行研究(基于属性的物料变异性研究)可以在物料筛选阶段进行,也可以在工艺表征阶段进行。不过,还是希望在工艺表征时,能够看到物料已得到稳健控制。
关键物料属性研究可以帮助选择物料的级别,更明智的选择物料供应商,制定物料的质量标准以及未来商业化生产中的持续监控。现阶段,监管申报文件中要求最好包含关键物料属性相关内容,因此,本文的内容将非常有助于制药企业制定该主题相关的研究和工作。
参考文献
[1] Chalk S: Raw material variability. Biopharm Int 2014, 27:38-39.
[2] Challenger CA: Biopharma takes on raw material variability. Biopharm Int 2016, 29:20-24.
[3] Reynolds G, Paskiet D: Glass delamination and breakage. BioProcess Int 2011, 9:52-57.
[4] Guideline ICH: Q7 good manufacturing practice guide for active pharmaceutical ingredients. Curr Step 2000, 4.
[5] ISPE Regulatory Landscape for Raw Materials: CMC Considerations. https://ispe.org/pharmaceutical-engineering/september-october-2022/regulatory-landscape-raw-materials-cmc
[6] Jennifer Maguire, Ph.D. Daniel Peng, Ph.D. Office of Process and Facility (OPF)
OPQ/CDER/FDA How to Identify Critical Quality Attributes and Critical Process Parameters. https://pqri.org/wp-content/uploads/2015/10/01-How-to-identify-CQA-CPP-CMA-Final.pdf
[7] PDA Technical Report No. 81 Cell-Based Therapy Control Strategy. 2018 Parenteral Drug Association, Inc.
[8] CMC Biotech working group, A-Mab, a case study in bioprocess development. Version 2.1,
关于康日百奥Bioworkshops
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。
康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)
















