Bio Share PC&PV | 统计学方法在QbD中的实践应用
发布时间: Mar 20 , 2024
执行QbD需要统计学助力
质量源于设计(QbD)是一个系统的药物开发方法。ICH Q8对质量源于设计具有明确的定义,即基于科学及风险管理的基础上,采用系统的方法对预定义目标产品进行开发,并强调对产品及工艺的理解以及工艺控制。[1]
基于QbD理念的药物开发需要首先确定药物的目标产品质量概况(QTPP),基于风险评估确定关键质量属性(CQA),借助工艺开发、工艺表征和工艺验证研究识别关键工艺参数(CPP)及其可接受范围,最终建立药物生产的控制策略。QbD药物开发方法可帮助获得稳健、可重复以及质量可保证的药物产品。[2]
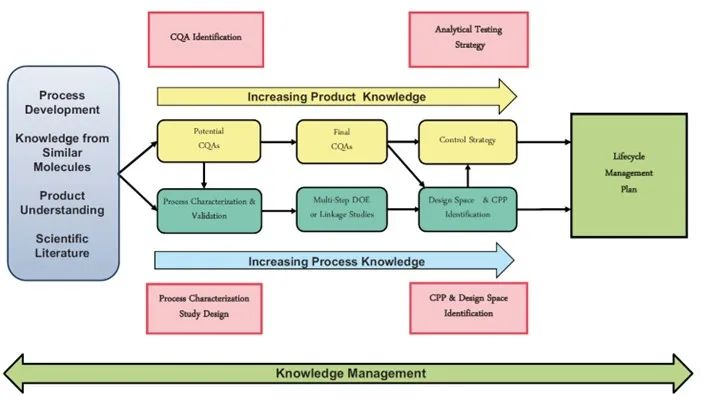
图1:基于质量源于设计(QbD)理念的药物开发路线图[2]
在执行QbD的过程中,统计学是不可或缺的工具。任何药物的开发都需要合理的和科学的数据与信息,以及对其的分析。基于统计学的数据分析是利用知识进行决策的基础。PDA技术报告60,工艺验证的生命周期方法中,曾总结过工艺验证期间所使用的统计学方法。其中一些同样适用于基于QbD的药物开发过程。[3]
适用于QbD药物开发过程的统计学工具可包含:
- 可视化工具:获取一组数据、总结相关信息并直观的显示这些信息,即可视化的过程。电子表格和统计学软件中的图形工具可实现该目的。
- 简单描述性统计:通常包括对数据集中趋势的描述(比如平均数、几何平均数、中位数或众数)和数据分散或变异性的描述(比如极差、标准差或方差)。
- 统计区间:量化不确定性的最有用工具,可包括置信区间、预测区间和容忍区间。
- 假设检验:用于比较和推断的正式统计过程,可用于工艺开发、可比性研究以及缩小模型的确认中等。
- 实验设计(DoE):一种系统的研究输入因子以及其与输出响应(包括工艺属性和质量属性)之间关系的方法,也是FDA和EMA法规指南中,关于QbD药物开发推荐和鼓励使用的方法。
- 多元数据分析:随着批次数据和光谱数据(比如过程分析技术产生的数据)的出现,需要使用高级的数据分析和建模工具,比如主成分分析、偏最小二乘分析,以及机器学习算法等。多元数据分析方法开的模型能够更好的建立输入数据与输出响应之间的预测关系,进而带来更显著的优势。
下面我们对在QbD药物开发中使用最多的统计学工具,假设检验和实验设计,进行详细介绍,包括其应用实践。
假设检验
原理介绍
假设检验是一种正式的统计程序,根据样本提供的证据来推断预期的总体参数的情况。简单举例,在工艺表征中,未来验证缩小模型的代表性,现在我们分别具有缩小模型和生产规模的几次数据(样本),以此来推断缩小模型的所有生产和生产规模下的所有生产(总体)是否一致或可比。[4]
针对该案例,常使用的假设检验方法为等价检验。我们将缩小模型的所有生产的数据均值记录为μ小,将生产规模的所有生产的数据均值记录为μ大。等价检验的目的是推断出μ小和μ大是否一致或可比。
在进行等价检验之前,我们需要确定一个等价区间(EAC),该区间定义为μ小和μ大之间的差异没有实际意义的区间。通常会选择生产规模样本数据的±3标准差作为等价区间。
构建一个互补的假设检验陈述,即:
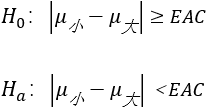
为了进行上述的检验,需要根据样本数据计算均值差的90%置信区间,然后将该区间与EAC进行比较。
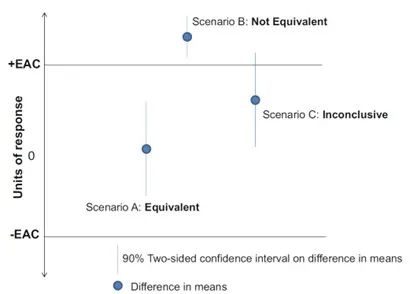
图2:等价检验的输出结果
情况A是缩小模型与生产规模的均值差的90%置信区间完全落在-EAC和+EAC之间,因此该等价检验的结论是两个规模的均值是等价的。而情况B和C中,置信区间至少有一些值不在-EAC和+EAC的范围内,因此不能生成两者等价。
当等价检验的结果为等价时,才可以下结论说缩小模型能够代表商业化生产的工艺,可用于工艺表征和工艺验证相关的研究中。
案例研究
宿主细胞系和单克隆细胞会带来翻译后修饰问题,会导致产品质量属性的变异,因此在选择时需要考虑这两个风险。比如曾有报道,不同的宿主细胞系表达的抗体具有不同的糖型图谱。
在实际的工艺表征和工艺验证研究中,为了验证缩小模型与商业化规模生产工艺,我们积累的各五批次的实验数据,即样本数据。
表1:缩小模型实验与生产规模数据
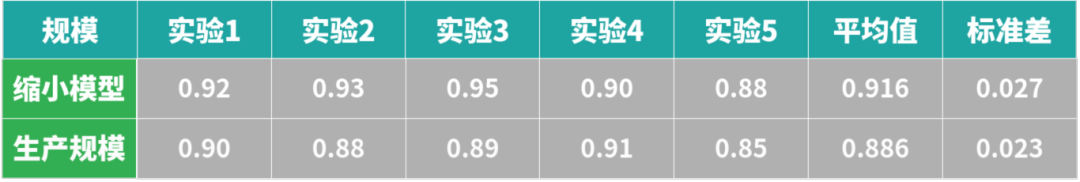
基于样本计算的缩小模型与生产规模的均值差(0.916-0.883=0.03)的90%置信区间为(0.0004806,0.0595194),该区间完全落在等价区间(±3生产规模标准差),即(-0.069,0.069)内。因此可认为两者是等价的。
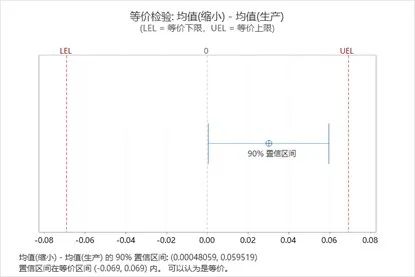
图3:缩小模型与生产规模等价检验的结果
该案例研究的结论是,缩小模型可作为商业化生产规模工艺的代表,即可以用于工艺表征和工艺验证的研究中。
实验设计(DoE)
原理介绍
在基于QbD的药物开发中,很重要的一步是建立输入因子(工艺参数和/或物料属性)与输出响应之间的关系,进而建立输入因子的设计空间。ICH、FDA和EMA的相关法规指南均鼓励和推荐在该步骤中使用DoE方法。
与传统的单因素实验方法相比,DoE方法的研究中,所有因子同时发生改变。借助科学合理的实验安排以及系统的数据分析可以获得更多的知识,不仅仅是每个因子的主效应影响,还包括因子之间的交互效应和二次项效应影响。另外,从经济性角度来看,实验设计也减少了实验次数,节省了工艺开发和表征研究的时间和资源。[5]
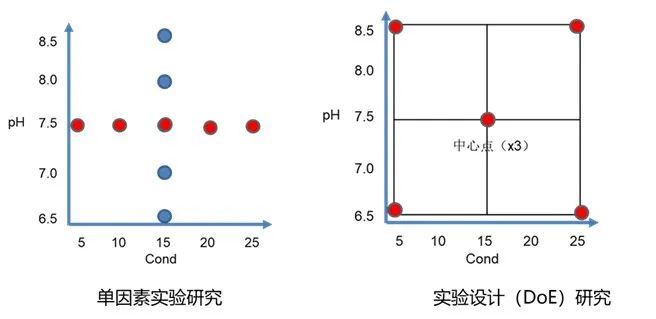
图4:单因素实验方法(左)与实验设计方法(右)
基于实验设计(DoE),我们可以(1)确定哪些输入因子具有统计学的显著性影响,可将其暂定为潜在关键工艺参数(pCPPs),以及(2)确定这些潜在关键工艺参数的可接受范围,即设计空间。这些目的的实现均依赖于实验设计背后系统的数据分析知识。
案例研究
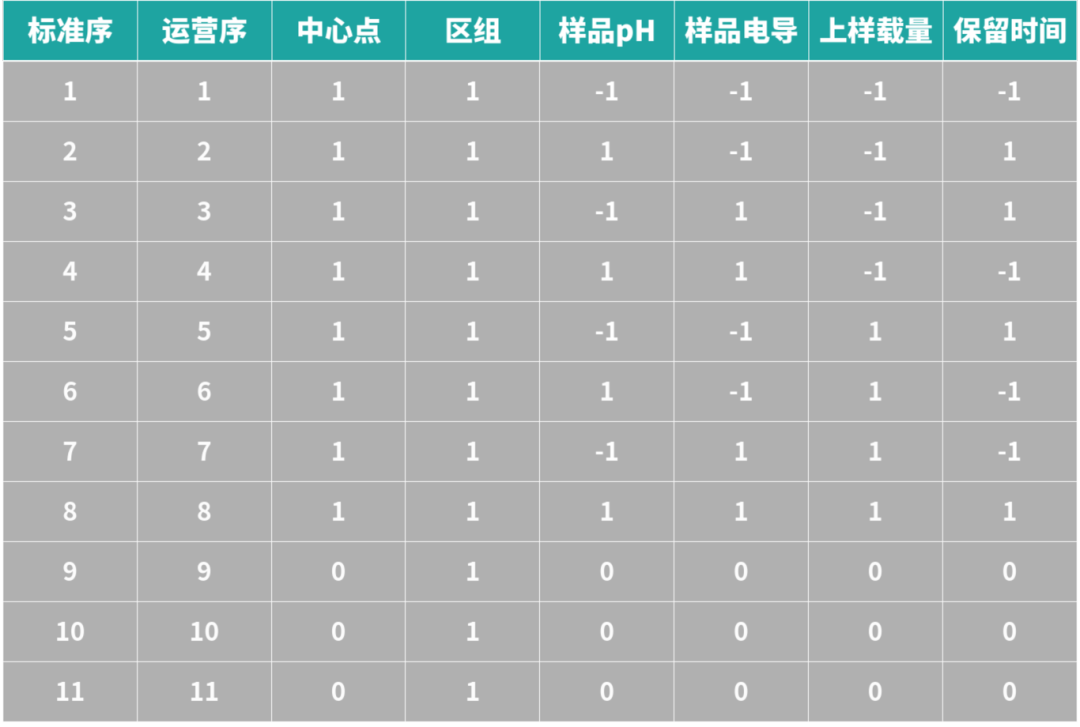
现在进行一个使用阴离子交换层析进行单克隆抗体的精细纯化,采用流穿模式,需要研究的输入工艺参数包括样品pH、样品电导、上样载量和保留时间。研究的输出响应则包括收率和聚集体含量。根据实验设计原理可以设计一个分辨率为IV的部分析因实验设计,共计需要进行11次实验。
表2:阴离子交换层析步骤的实验设计
在获得11次实验的收率和聚集体含量的检测结果后,通过实验设计的统计分析,可以显示四个工艺参数对收率和聚集体含量是否具有显著性影响。如下图,样品pH、样品电导和上样载量对收率具有显著性影响,保留时间对收率没有显著性影响。另外,样品pH和样品电导对聚集体含量具有显著性影响,而上样载量和保留时间则对聚集体含量没有显著性影响。
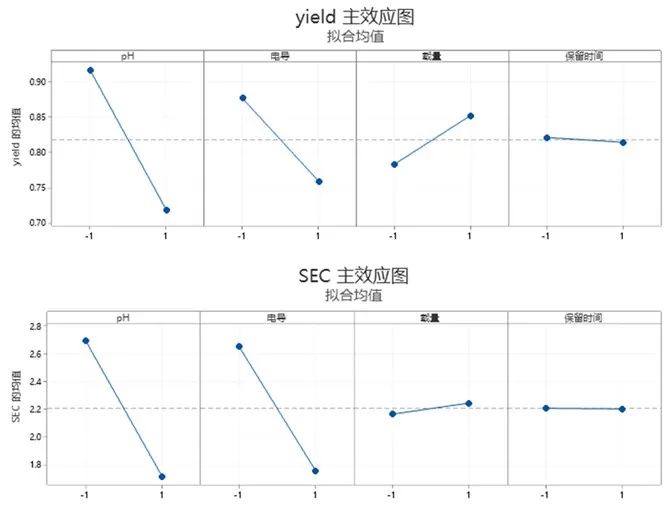
图5:工艺参数对收率和聚集体影响的统计学分析
建立最小二乘法的回归方程,则可以根据回归方程刻画收率和聚集体含量的等高线图,从而确定关键工艺参数的设计空间范围。如下等高线图,收率和聚集体含量相对于样品pH和样品电导的等高线图,如果设定收率>80%,聚集体含量<2.5%,那么图中的白色区域即为两个属性均可接受的区域。能够实现该区域的工艺参数(样品pH和样品电导)的范围即为所需要的设计空间。

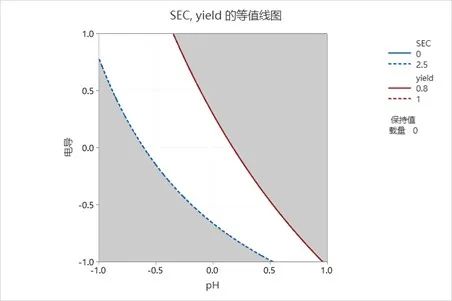
图6:样品pH和电导的设计空间范围(白色区域所示)
基于上述案例的分析,我们可以确定对阴离子交换的精细纯化,样品的pH和电导对收率和纯度具有显著性影响,可暂设定为潜在关键工艺参数,其可接受范围(或设计空间)可基于等高线图的结果而定。
总结
基于QbD的药物开发已经成为现在药物开发的趋势,也符合药物监管的期望。QbD是一个基于科学和风险的系统方法,统计学是实现QbD的一个重要工具[2]。本文中介绍了QbD会用的统计学方法,并详细介绍了假设检验和实验设计两个工具及其应用实践案例。通过这两个案例,我们可以看到统计分析所带来的系统知识,这对于保证未来稳健、可重复以及保证质量的商业化生产极具有优势。

参考文献
[1] ICH Q8 R2 PHARMACEUTICAL DEVELOPMENT 2009年
[2] Lynne K, Christof F. Introduction to the application of QbD principles for the development of monoclonal antibodies. Biologicals 2016;44(5):282e90.
[3] PDA Technical Report NO 60:Process Validation: A Lifecycle Approach, 2013年
[4] 马逢时, 六西格玛管理统计指南 2013年
[5] Cytiva, design of experiments in protein production and purification, handbook 29-1038-50 AA
关于康日百奥Bioworkshops
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。
康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)

















