Bio-Share PC&PV | 抗体药物的表征分析方法解析
发布时间: Sep 14 , 2023

抗体药物的表征分析
Bio-Share PC&PV
每批次的抗体进行常规的工艺中控制和放行检测之外,还需要进行进一步的生物化学和生物物理学的表征分析。这些表征分析数据可以支持抗体药物制剂临床的开发、有助于证明工艺放大、工艺变更或技术转移后产品的可比性[1]。
不需要对每批次的抗体药物都进行表征分析,但所选择的表征分析方法应尽可能完整的描述和证明产品的结构和变化。当然,有些表征分析方法也可以用于中控和放行检测,比如肽图分析,既可以用于表征一级结构、二硫键或翻译后修饰等(表征分析),也可以用于常规的鉴别检测(放行检测)[1]。
下面表格列出了抗体药物常用的表征分析方法及其所提供的产品结构信息。本文将对其中一些代表性的表征分析方法进行详细解析。
表1:抗体药物的表征分析方法[1]
N端和C端测序证明抗体药物具有正确的N端和C端序列,是确认产品一级结构以及确认是否存在不同形式的抗体药物的分析方法。通常使用标准的Edman降解进行N端测序,测定重链和轻链的N端5-10个氨基酸残基,然后与预期序列进行比较,也可以使用肽图分析的方法确认N端序列[2]。C端氨基酸序列则通常需要将抗体酶解为肽段,然后进行肽段的测序确认,这通常会作为肽图分析的一部分来进行。
肽图分析
Bio-Share PC&PV
如上看到,抗体药物的表征分析,很多时候需要将蛋白进行蛋白酶水解,断开骨架,从而将蛋白裂解成小肽段,随后使用反相高效液相色谱对裂解产生的肽段进行分析,这种技术称为肽图分析。
基于肽图分析可以确定蛋白的降解产物,比如天冬酰胺的脱酰胺或甲硫氨酸的氧化;可以确认或验证二硫键的连接;确定糖基化的位点;结合质谱分析还可以用于蛋白的鉴定、序列分析等[3]。
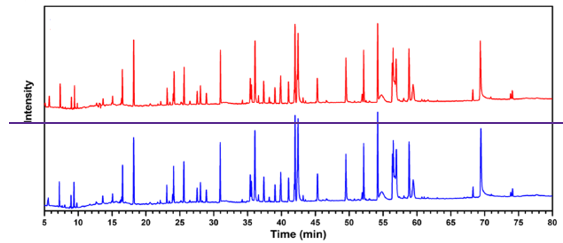
图1:典型单抗药物的胰蛋白酶肽图分析
质谱分析
Bio-Share PC&PV
质谱分析(MS)是通过多种方式在蛋白上产生电荷,然后通过磁场和/或电场加速蛋白来进行分离,蛋白的加速度正比于其质荷比,最后在检测器中被俘获,进而分析。蛋白电离可通过稀有气体的原子轰击(FAB)、基质辅助激光电离(MALDI)、电喷雾电离(ESI)实现。分析检测器通常包括飞行时间(TOF)或四级杆类型。质谱仪的类型则通常使用电离器和分析检测器类型来描述,比如MALDI-TOF质谱。
质谱分析可以获得有关抗体药物分子量的准确信息。除此之外,还可以通过使用激发能使抗体片段化来获得其序列的相关信息,比如轻链和重链分子量。使用两个直连的质谱仪(MS/MS)可以使抗体产生更多的片段。当今MS/MS的高质量和高灵敏度可以提供有关氨基酸氧化、脱酰胺以及一级结构方面的信息[4]。
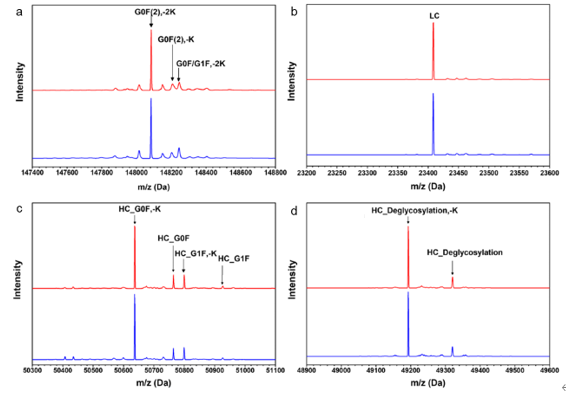
图2:典型单抗药物的质谱分析图
(a)完整单抗分析;(b)还原轻链分析;
(c)还原重链分析;(d)还原和去糖重链分析
多属性方法(MAM)
Bio-Share PC&PV
多属性方法(MAM)在生物制药中得到越来越多的关注和应用,这是一种基于LC-MS的肽图分析方法。现在的MAM具有同步检测、识别、定量和QC功能,已经成为一种系统性的方法,尤其是对于新型的分子形式,MAM具有特别的优势。
通过对抗体产品进行酶消化(通常为胰蛋白酶),进行LC-MS或LC-MS/MS分析,其数据进行全面的数据库搜索来评估产品质量属性。当该质量属性为CQA时,可对其进行靶向属性定量。除此之外,MAM提供的新峰检测(NPD)功能来探索产品的降解物或变体。
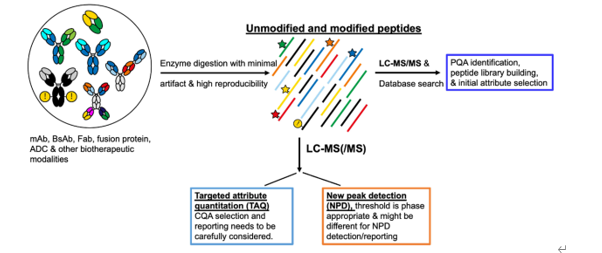
图3:多属性方法(MAM)的典型工作流程
光谱方法
Bio-Share PC&PV
可用于抗体药物表征分析的光谱方法包括圆二色谱、傅里叶变换红外光谱以及荧光光谱等。
圆二色谱(CD)是一种光吸收现象,其原理是基于分子(比如抗体分子)在远紫外区域(190-250nm)或近紫外区域(230-250nm)影响左右偏振光方式的差异来进行分析。不同的分子结构产生的光强度信号不同,因此可用于分析分子结构。远紫外CD对二级结构更敏感,而近紫外CD对三级结构更为敏感[5]。
CD是一种样品无损的分析技术,可快速获得结果,并且可得到各种条件下,比如不同pH、不同温度下的信息。CD对样品浓度要求稍高,比如0.5-1.0mg/ml。
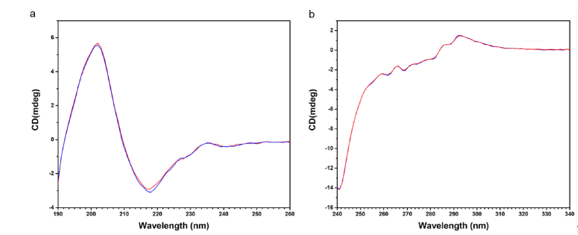
图4:典型单抗药物的圆二色谱(CD)
(a)远紫外CD光谱;(b)近紫外CD光谱
傅里叶变换红外光谱(FTIR)测量入射能量与分子内电偶极相互作用时在特定能量下吸收的入射红外辐射,可用于分析蛋白的二级结构,比如α螺旋或β折叠的存在和相对数量的信息。
荧光光谱是指蛋白被近紫外到蓝光波长的激光激发,可诱导抗体药物中的色氨酸残基发出特征性荧光,该荧光光谱的变化可以反映色氨酸残基周围的微环境,因此荧光光谱对蛋白的三级结构非常敏感,因为变性、降解或者聚集都会导致三级结构变化,从而引起荧光最大波长或强度的变化。
差示量热扫描(DSC)
Bio-Share PC&PV
差示量热扫描(DSC)提供的是抗体药物热稳定性的相关信息。抗体药物折叠成热力学最稳定结构的区域要比结构不稳定的区域需要更多的能量来展开。相变温度(Tm),即样品中50%的分子未折叠时的温度,是分子三级结构的函数。抗体药物通常具有多个相变温度点[1]。
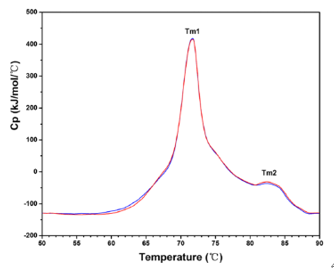
图5:典型单抗药物的差示量热扫描(DSC)分析
聚集体的表征分析
Bio-Share PC&PV
对于抗体药物的聚集体,通常可使用SEC-HPLC或SDS-PAGE进行工艺中控制或放行检测。为了更详细的表征抗体药物,一些精细的分析方法,比如多角度激光散射(MALLS)、分析型超速离心(AUC)和场流分离(FFF)也会用于表征抗体药物的聚集体[1]。
多角度激光散射(MALLS)是利用溶液中蛋白质对已知光的散射行为进行分析,基于数据可计算溶液中分子的分子量。分析型超速离心(AUC)是基于蛋白质或其聚集体在离心场中,通过梯度溶液时的迁移率来进行分析,该迁移率是分子半径的函数。场流分离(FFF)是通过施加垂直于样品,通过狭窄通道的流场将溶质分层固定在膜上来实现的,分子沿着流动路径的运动是分子量的函数。FFF可以同时分析出共价和非共价聚集体。
糖型表征
Bio-Share PC&PV
抗体药物表征分析的一个关键部分是糖型的分析,包括糖基化位点、糖型和各寡糖含量等。肽图分析可以用于鉴定单克隆抗体产品中的糖基化位点以及位点的占有比例。利用MS/MS或者N端测序分析对肽图分析中释放的肽段进行分析,可以鉴定出产物中每个糖基化位点的确切位置。每个位点的占有率则可以通过测定含有糖基化位点的肽段在有或者没有糖链的情况下的相对含量来确定。
确定每种糖型的结构首先使用PNGaseF酶从单克隆抗体上切割下完整的寡糖,然后通过HPLC分离不同的寡糖结构,使用一种或者多种方法进行测定。每个寡糖的结构信息可以通过将样品的洗脱时间与在相同色谱条件下同时运行的一系列标准寡糖进行比较来确定。或者可以通过质谱法来确定寡糖的结构。将此方法确定的寡糖结构与先前确定的单糖组成数据相结合,可以确保糖型的准确性[6]。
活性表征
Bio-Share PC&PV
表面等离子共振(SPR)技术是一种基于光学原理的新型分析技术,当光在棱镜与金属膜表面上发生全反射现象时,形成消逝波进入到光疏介质中,而在介质中又存在一定的等离子波,在基于能量守恒的前提下两种波段相遇时可能会发生的共振现象。
基于SPR技术可以用来表征抗议药物的相关的功能活性,包括抗原抗体亲和力以及Fc与FcγRIa、FcγRIIa、FcγRIIb、FcγRIIIa、FcγRIIIb、FcRn和C1q的结合活性等[7]。
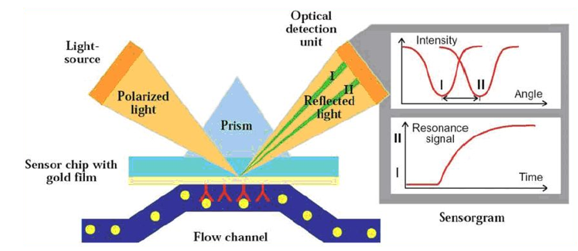
图6:表面等离子共振(SPR)技术的原理图
另外一种可以表征抗体药物相关功能活性的方法是生物膜干涉技术(BLI)。与SPR不同,BLI技术是利用光纤生物传感器来实时检测分子结合与解离时传感器光学层厚度的变化。生物膜厚度的变化会导致干涉光波发生相对位移,从而被光谱仪检测到。通过对分子结合前后的图谱变化来对待检测分子进行分析。
因此,BLI技术也可以用于抗体药物的亲和力和动力学的测定,从而表征抗体药物的功能活性。
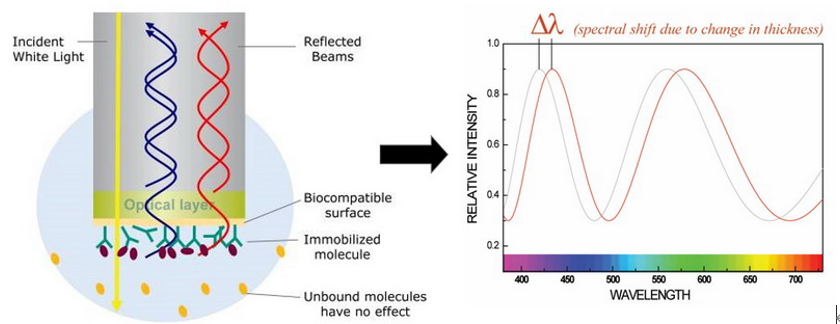
图7:生物膜干涉(BLI)技术的原理图
总结
Bio-Share PC&PV
抗体类药物是一种生物大分子药物,其结构复杂,由于生产工艺和保存条件的不同还会产生不均一性,系统而全面的表征分析对于确保其安全性和有效性至关重要,也是非常重要的手段。本文介绍了抗体药物表征分析的几种主要分析方法,并进行了解析,但是要理解,随着分析技术的发展,将会有越来越多更精确和更灵敏的技术产生,从而补充现有的分析手段。
参考文献:
[1] Howard L. Levine, Brendan R. Cooney The development of therapeutic monoclonal antibody products, a comprehensive guide to CMC activities from clone to clinic.
[2] Allen G. Sequencing of proteins and peptides. Second ed. New York: Elsevier Science Publishing Company; c1989. Chapter 6, Determination of peptide sequences; p. 207-93. (Laboratory techniques in biochemistry and molecular biology; vol. 9).
[3] Dougherty J, et al. Using peptide maps as identity and purity tests for lot release testing of recombinant therapeutic proteins. BioPharm Int. 2003 Apr;16(4):54-8.
[4] van den Bremer ETJ, Heck AJR. Mass spectrometry in protein conformational analysis and molecular recognition. In: Jiskoot W, Crommelin D, editors. Methods for structural analysis of protein pharmaceuticals. Arlington (VA): American Association of Pharmaceutical Scientists; 2005. p. 435-64.
[5] Greenfield N. Using circular dichroism spectra to estimate protein secondary structure. Nat Protoc. 2006; 1(6): 2876-2890.
[6] Jefferis R. Glycosylation as a strategy to improve antibody-based therapeutics. Nat Rev Drug Discov. 2009 Mar;8(3):226-34.
[7] 王鸣人,段徐华,邵泓,陈钢.表面等离子共振(SPR)技术在生物药物质量控制中的应用前景[J].中国药师,2020,23(11):2257-2260.
关于康日百奥
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)
















