Bio-Share 工艺验证 | 生物制药的工艺性能确认(PPQ)
发布时间: Feb 01 , 2023
随着工艺验证进入QbD时代,FDA的新工艺验证指南将工艺验证分为三个阶段,今天我们要讲述的工艺性能确认(PPQ)是阶段2(工艺确认)中一个主要活动。工艺性能确认(PPQ)标志着产品从开发和临床到常规商业化的转变,通过验证工艺控制策略为上市后的商业化生产提供信心。
PPQ的法规要求
无论FDA、EMA法规指南,还是PDA技术报告,都同意工艺性能确认(PPQ)是在商业化规模上确认和验证最终生产工艺能够有效的执行,并生产出符合质量标准的产品。因此,需要连续运行适当数目的PPQ批次来确认商业化工艺可以按照预期实施。
工艺性能确认(PPQ)需要在商业化销售药品之前成功完成,PPQ的数据应当包含在监管申请的文件中。与常规的商业化生产相比,PPQ一般会有一个较高水平的取样、检测和标准,以确认工艺的一致性。[1]
工艺性能确认(PPQ)的批次还要求应当是连续的运行。当PPQ批次不能连续时,需要分析失败的原因,如果PPQ失败是由于与工艺无关或已知的可确定原因,比如操作员或者设备,可以予以解释。最终的PPQ报告需要包含失败或无效批次,包括失败的原因分析。[2]
PPQ的准备就绪
准备PPQ的一部分工作会在阶段1即开始,比如工艺验证主计划,车间、公用设施和设备的确认,起草PPQ的方案,人员培训以及起草最初的持续工艺确认计划等;在进行PPQ之前需要确定以下要素是否准备就绪:
- 目标产品质量概况,是否根据第一阶段的知识进行了更新;
- 关键质量属性的关键性评估,需要进行审查和更新;
- 商业化生产工艺的描述,包括第一阶段确定的生产工艺以及PPQ之前的车间、公用设施和设备导致的变更;
- 分析方法,应已经完成分析方法的验证或者确认;
- 商业化批次的批记录,在PPQ之前应批准最终商业化工艺的批生产记录;
- 工艺设计报告,应完成工艺设计报告;
- 工艺验证主计划,在PPQ之前完成;
- 质量系统和培训,人员的培训是必须的,所有的PPQ研究应该质量系统的监督管理下进行;
- PPQ方案,应批准所需要研究的每一个方案;
PPQ的设计策略
在设计和撰写PPQ方案之前,需要了解PPQ的设计策略,并且能够解决以下问题:
1. PPQ的批次数目
FDA新工艺验证指南中认为PPQ的批次数目会受多种因素的影响,比如阶段1的获得的产品和工艺知识,生产技术的类型和复杂性,以及原材料和操作人员经验的变异性等。FDA法规指南认为应当基于风险或者科学(比如统计学)的方法来确定PPQ的批次数目。
EMA工艺验证指南和PDA技术报告则写到PPQ至少需要连续三个批次的成功运行。[3]

图1. 基于风险和科学来确定PPQ的批次数目。[2]
2. PPQ的操作条件
EMA工艺验证指南写到PPQ一般选择在正常操作条件下来评估商业化工艺的受控状态,一般没有必要在PPQ内运行整个操作范围。阶段1的工艺表征研究所建立的工艺设定点和操作范围是PPQ研究中操作条件选择的基础。
3. PPQ的研究方法
与工艺表征研究一致,PPQ的确认也是通过对单独的单元操作进行验证来实现,因此,需要对每个单元操作编写单独的方案,应当规定单元操作的输出(中间体)的检测项目和可接受标准。最终总体目标是实现整个工艺的PPQ成功。
4. PPQ的设计方法
PPQ运行的设计可以使用括号法、矩阵法和家族法等设计方法。
括号法确认代表了工艺变量极端情况的工艺,前提是极端情况可以充分代表中间情况,比如中间体缓冲液的保存时间研究,选择最大体积和最小体积的储罐来进行操作;
矩阵法适用于相同的工艺和产品配置有不止一种变化时的商业化生产的PPQ,该方法基于的假设是选定的包括在PPQ中的批次配置可代表所有组合情况下的工艺;
家族法适用于有多个相关但不相同的实体能被分组以便单个实体能够代表共同的性质或者每组的最差情况,分组和选择代表性情况的判定理由应包括在验证总计划和PPQ方案中。比如设备家族,如下所示的三台生物反应器的PPQ验证则采用了家族法方法。

5. PPQ的取样策略
在PPQ运行中,应当适当的增加取样和分析实验来证明工艺受控、中间体和成品的一致性。如果取样受限,也可以考虑增加检测类型,比如表征检测,或者进行非常规取样来证明工艺的受控和重现性。
6. PPQ的可接受标准
PPQ应当规定可接受标准,比如工艺参数应保持在正常的操作范围内,尤其是关键和重要工艺参数;比如所有产品的质量属性和工艺性能属性以符合预期的接受标准,适当的时候还要包括统计学标准。
PPQ的可接受标准应建立在第一阶段获得的有效数据、先验知识以及设备能力的基础上,比如工艺表征中建立和捕获的工艺知识与理解。
PPQ运行的结果是否在可接受标准内决定了PPQ运行批次是否成功。借用某CDMO公司的报告,当PPQ运行中关键工艺参数(CPPs)和关键质量属性(CQAs)不在可接受标准内时,将会导致PPQ的失败。

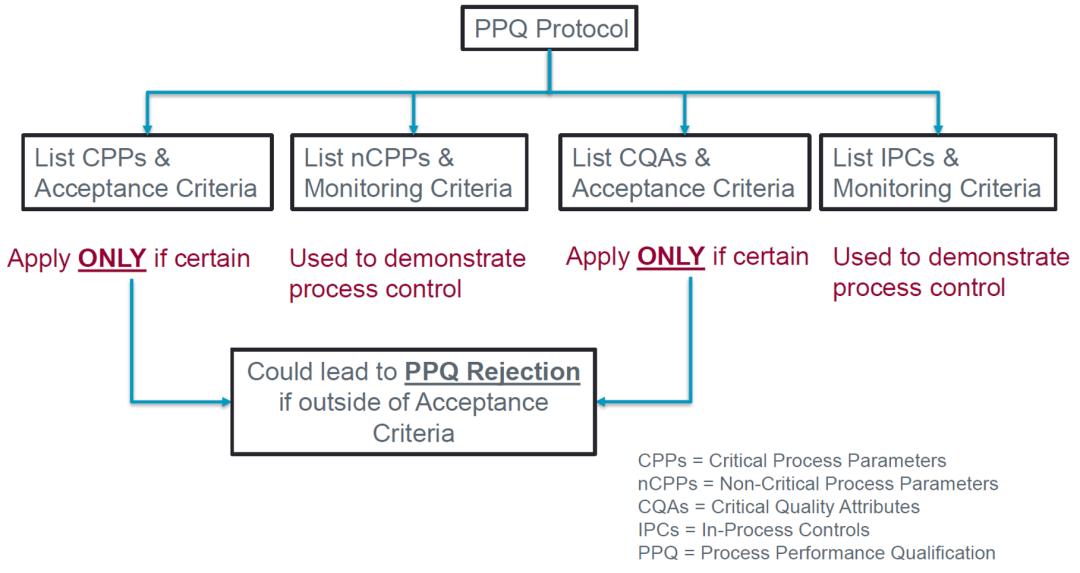
图2. PPQ运行结果的决策树(来自网络公开报告)
PPQ方案
PPQ方案是执行PPQ研究的计划文件。PPQ方案需要包括质量部门在内的多职能团队进行审核和批准,并且PPQ方案必须在PPQ开始前完成。
典型的PPQ方案可包括以下部分:
- 介绍
- 目的和适用范围
- 参考文献
- 设备和物料
- 职责
- 单元操作/工艺描述
- 方法学
- 数据收集
- 取样计划
- 分析检测
- 偏差
- 可接受标准
PPQ报告
典型的PPQ报告可包含以下内容:
- 介绍
- 方法和材料
- 偏差和处理
- PPQ结果及讨论
- 总结
总结:
工艺性能确认(PPQ)标志着产品工艺从设计和开发过渡到商业化生产。PPQ的成功为该产品工艺能够持续可靠的商业化运行提供了高度的信息,因此,PPQ是产品注册申报中最为重要,必不可少的环节。设计一个完美的PPQ运行,或者寻找一个合格的CDMO完成PPQ运行,都是BLA成功申报的坚实基础。
PPQ成功以后,就进行持续工艺确认(CPV)计划的敲定和实施了,所有在PPQ基础上进行的调整都应在商业化生产之前就位。通过该流程的商业化工艺才能持续、稳健的提供安全和有效的药品,满足患者和市场的需求。

康日百奥生物科技(苏州)有限公司作为一站式生物药CDMO服务商,提供从细胞株构建、细胞培养工艺开发、分析方法开发、制剂处方工艺开发、纯化工艺开发、工艺表征、工艺验证以及原液和成品的cGMP生产。康日百奥致力于为合作伙伴提供高质量,高效率的生物药开发生产服务。在工艺表征阶段,我们建立完整的方法流程,基于工艺参数的风险评估、缩小模型的建立和确认、工艺表征实验、控制策略的建立、和风险评估更新等一系列工艺表征步骤,制定了完整的工艺控制策略,并可应用到商业化生产过程中。

康日百奥搭建有完整的工艺表征技术平台,针对市场主流的商业化规模反应器系统建立了相应的缩小模型,可针对影响产品关键质量属性的中高风险参数进行多变量实验设计,基于关键质量属性的识别,为商业化规模生产工艺参数确定了科学合理的参数范围,用于支持后续的工艺验证环节和药品上市申报。同时,根据不同合作伙伴项目的独特性,制定相应的技术转移、工艺开发、工艺表征及放大生产方案。
康日百奥作为一家专业的生物药CDMO服务供应商,拥有强大的工艺开发团队,在工艺表征和工艺验证的项目上都拥有丰富的知识积累及充足的实战经验,保证客户项目的顺利交付。团队成员已经帮助多家国内外知名公司成功转移、放大和生产2000 L的临床和商业化产品,同时具有丰富的药品申报上市经验,其中包含多批具有较高技术难度,从3L直接放大至2000L的生产项目,成功率100%。
参考文献
1. FDA Guidance for Industry, Process Validation: General Principles and Practices” 2011.
2. PDA Technical Report NO 60:Process Validation: A Lifecycle Approach, 2013
3. EMA Guideline on process validation for the manufacture of biotechnology-derived active substances and data to be provided in the regulatory submission 2016
















