Bio-Share 工艺验证 | 基于QbD的工艺验证生命周期方法
发布时间: Dec 07 , 2022
工艺验证的历史
药物生产工艺验证的概念开始于1970年代,最初的工艺验证是为了响应无菌制剂的微生物污染风险的问题。1970-1971年间,几家医院的大剂量注射剂产品中发现大肠埃希菌和欧文氏菌的污染事件。
因此,最初工艺验证的侧重点是微生物污染的控制,主要包含无菌保证和无菌工艺的验证,比如湿热灭菌和干热灭菌器的验证以及培养基灌装的微生物挑战等。后来,工艺验证的范围逐渐扩展,开始包含设备和车间的验证,清洁验证,混合验证,分析方法验证,计算机系统验证,保存时间验证等等。1
1987年,FDA颁布了"工艺验证指导原则指南",该版指南代表了制药行业关于工艺验证的最佳时间以及监管机构的期望。行业企业也意味等到了工艺验证的一个明确“清单”。
可是,在1990年代,FDA发现几家大的制药公司在各种与质量相关的系统上存在重大缺陷,从而下发警告信。行业通常反馈是建立稳健的工艺验证和工艺控制程序,以此来安抚监管机构。但是,有些时候,这些验证和程序在实际运营中难以维持。千篇一律的验证方法似乎并不在适合制药行业的现状。
2000-2010年期间,ICH相继颁布了ICH Q8"药物开发",ICHQ9"质量风险管理",ICHQ10"药品质量体系"和ICHQ11"原料药的开发和生产",并提出了质量源于设计(QbD)的药物开发理念。与此同时,FDA和制药行业企业也开始意识到,经典的三批工艺验证批次并不能真正降低工艺的风险,而工艺开发活动才是真正工艺风险缓解的地方。
2006年,FDA决定要修改1987年版的工艺验证指南。并在2011年正式颁布"工艺验证:一般原则与实践"的法规指南,行业内称之为"新工艺验证指南"。新工艺验证指南不再强调"清单"项目,而是希望制药企业能基于科学和风险的方法进行工艺验证,并能够向监管机构展示他们对工艺的控制。新工艺验证指南将工艺验证扩展到药物的全生命周期内,即生命周期的验证方法。

图1. 2011年版FDA工艺验证指南,"工艺验证的一般原则与实践"。2
这种理念非常契合了"质量源于设计"(QbD),因此,也有人认为工艺验证开始进入了QbD时代。2013年,PDA发布了技术报告60:"工艺验证,生命周期的方法",完整而详细的解释了FDA的新工艺验证指南。3
2016年,EMA发布"关于生产生物技术来源的活动物质的工艺验证及在注册申报中需要提交的数据的指南"。至此,新工艺验证的理念和思路开始在制药行业中广泛应用。4
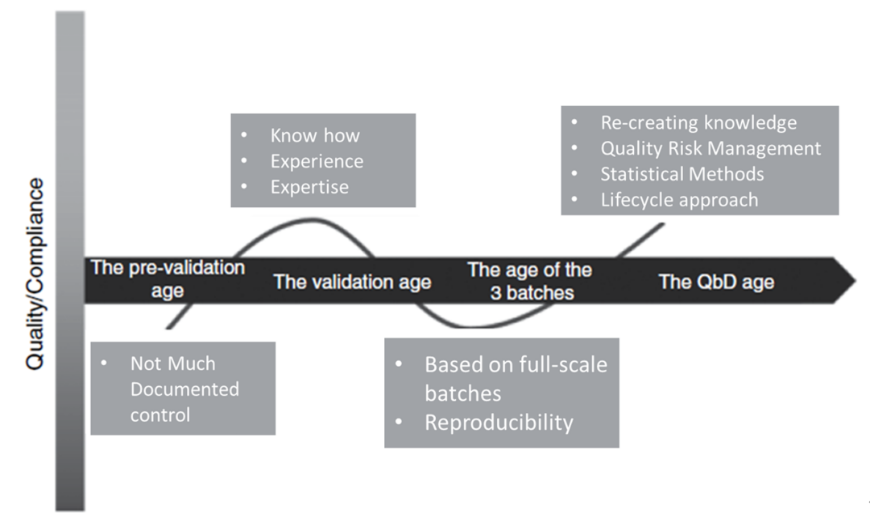
图2. 工艺验证进入QbD时代。1

2011年版的FDA新工艺验证指南将工艺验证定义为“收集和评估从工艺设计阶段到商业化生产的数据,用这些数据建立科学依据来证明该工艺能够始终如一的生产出符合质量标准的产品”,同时基于此,将工艺验证分为了三个阶段,涵盖了制药的整个生命周期:
阶段1:工艺设计,在这一阶段,基于从开发和工艺放大过程中得到的经验来定义商业化生产工艺。
阶段2:工艺确认,在这一阶段,对已设计的工艺进行评估,证明该工艺能够进行重复性的商业化生产。
阶段3:持续工艺确认,工艺的可控性在日常生产中得到持续地保证。
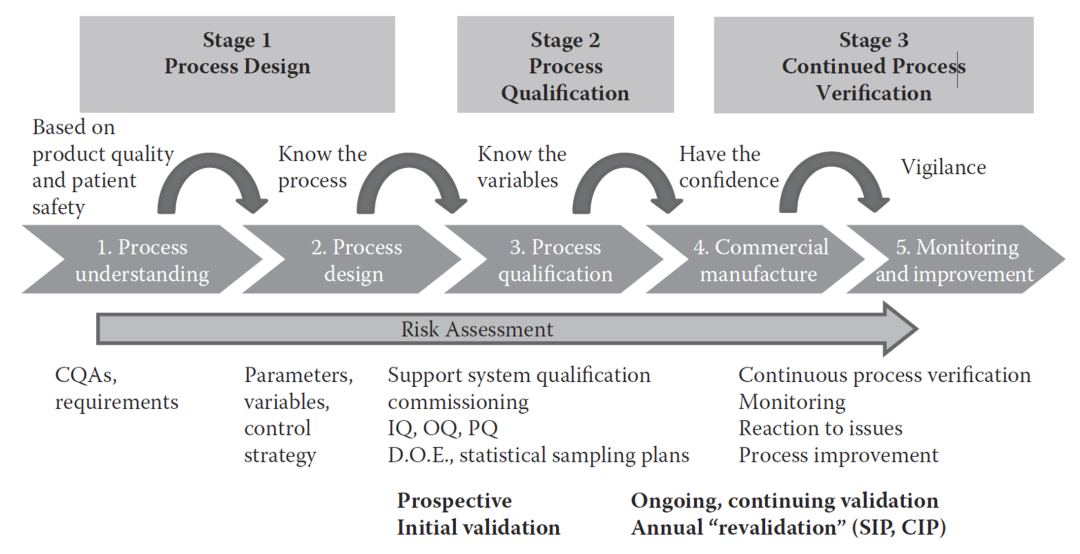
图3. FDA新工艺验证的三个阶段。1
2013年PDA发布的技术报告60:“工艺验证,生命周期的方法”中详细阐述了工艺验证的三个阶段内可进行的活动以及每个阶段的输出。2021年PDA更新发布的技术报告60-3“工艺验证,生命周期方法附件2,生物制药原液的生产”,将三阶段的活动和内容更加细化,并且更适合生物制药企业的实际操作。5
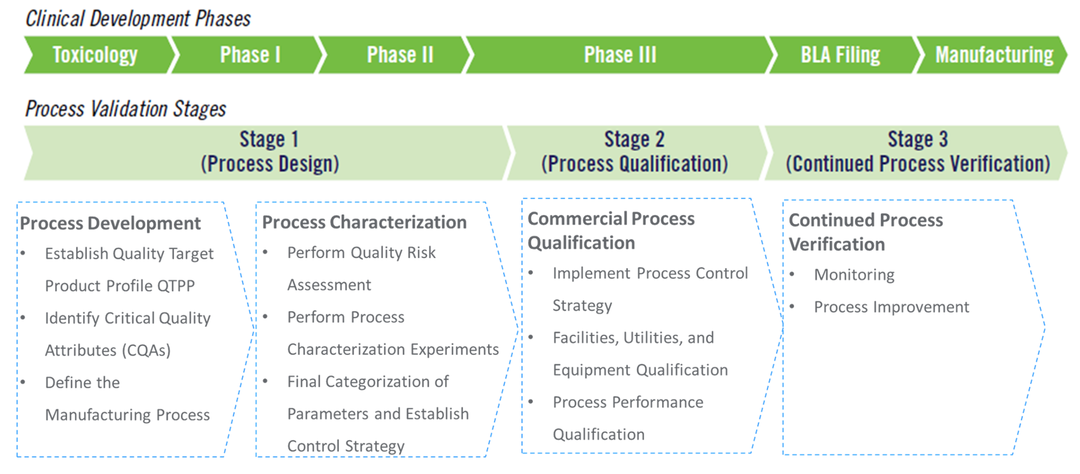 图4. 工艺验证三阶段内的主要活动。
图4. 工艺验证三阶段内的主要活动。
01工艺设计,建立和捕获工艺知识与理解
工艺验证的阶段1(工艺设计)主要包括两个主要活动,工艺开发和工艺表征。通过阶段1的活动,制药企业可以建立和捕获工艺知识与理解,最终形成稳健的工艺控制策略,因此,生产工艺描述和工艺设计报告是阶段1的最主要文件输出。
工艺开发的目的是定义生产工艺,包括建立产品的目标产品质量概况(QTPP)和关键质量属性(CQAs),细胞系和细胞库的建立、上游和下游工艺的开发、制剂处方和制剂工艺开发、分析方法开发以及相应的工艺放大研究。开发一个稳健的工艺是工艺验证成功的坚实基础。
工艺表征的目的是建立控制策略。在工艺表征中,通过一系列记录在案的实验研究,其中工艺参数被有意的变化以确定它们对工艺性能或质量属性的影响,同时获得工艺参数和工艺性能/质量属性的可接受范围,从而制定工艺控制策略。
工艺表征研究中捕获的工艺知识与理解以及基于此建立的控制策略将是阶段2(工艺确认)的输入。阶段2即是在商业化规模上确认该控制策略的可行性与可操作性,从而完成BLA之前的工艺验证工作。
康日百奥(公众号)已经为大家总结了工艺表征研究内容和实现步骤,详细信息可查阅:
02工艺确认,验证控制策略
工艺验证的阶段2(工艺确认)也主要包括两个主要活动:
(1)车间、设备和公用设施的设计和确认;
(2)工艺性能确认(PPQ)运行。
车间、设备和公用设施的设计和确认包括其工程与设计、安装确认、操作确认和性能确认,以及确认过程中的偏差和文件记录,这些都需要在工艺性能确认(PPQ)批次运行之前完成,审核并经过批准。
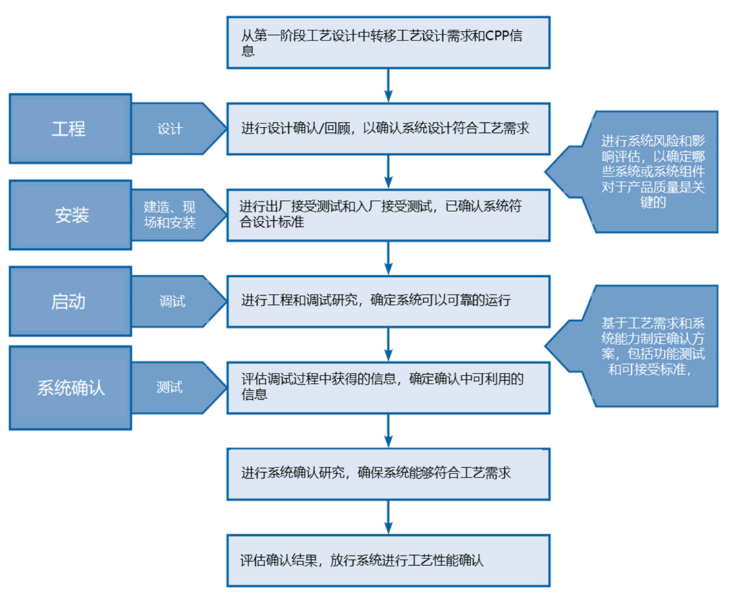
图5. 系统确认的一般顺序和相应活动。3
工艺性能确认(PPQ)是工艺验证的主要元素,将实际的车间、共用设施、设备(已经完成确认)和商业化生产训练有素的人员、控制程序以及各种组件结合在一起,生产商业化规模批次的产品。一个成功的PPQ可以确认工艺设计(阶段1)并证明商业化工艺可以按照预期实施。
与PPQ同步或分开,还会进行一些支持性的工艺验证活动,比如工艺中间体的稳定性研究,工艺溶液稳定性研究,层析介质和超滤膜包的寿命、清洁和保存验证,析出物和溶出物评估等。这些支持性研究连同PPQ批次共同支持了工艺验证的阶段2(工艺确认)活动。
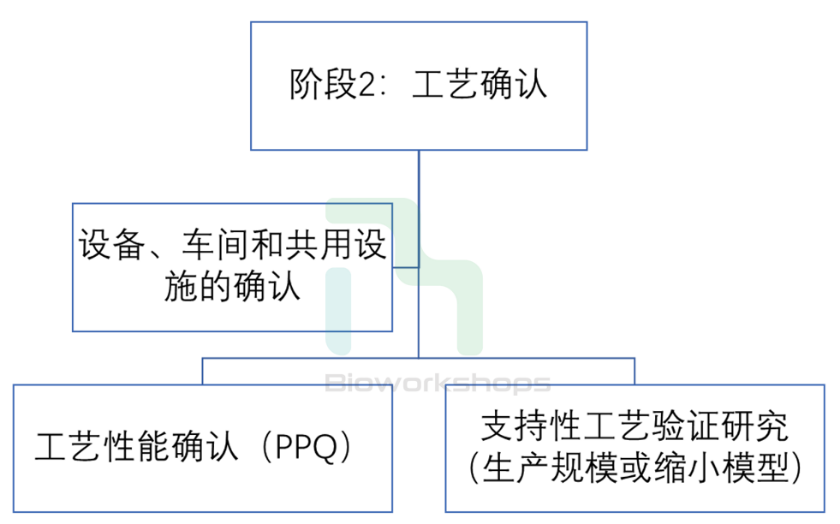
图6. 工艺确认阶段主要活动。5
03持续工艺确认
产品上市之后需要继续进行工艺的监测和评估,以提供证据,证明该工艺在商业化生产阶段仍处于已验证过的受控状态,这个过程称为持续工艺确认。
持续工艺确认的基础是验证阶段1设计和阶段2确认的控制策略,通常通过对中间体、原液或制剂的取样和检测,以及数据的趋势分析来实现。检测策略应至少包括批次放行检测,另外还应考虑包含关键工艺参数和中间体的关键质量属性指标,以及能够代表工艺一致性的性能指标。
良好的持续工艺确认设计和数据分析可以发现阶段1和阶段2没有展现的变异源,从而带来工艺改进的机会,同时获得越来越稳健的工艺控制策略。
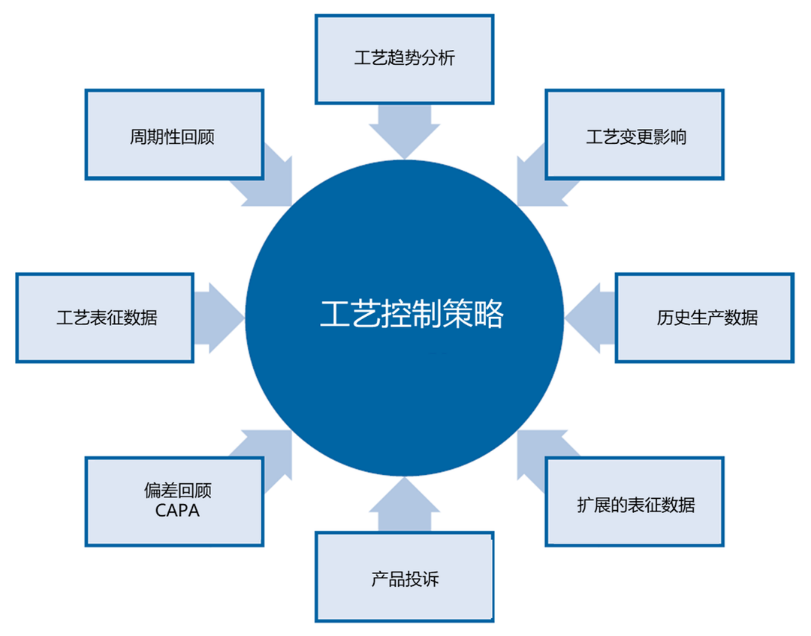
图7. 持续工艺确认有利于工艺控制策略的改进。3
















