Bio-Share 工艺表征 | 缩小模型的建立和确认
发布时间: Oct 13 , 2022

缩小模型的建立和确认
为何需要缩小模型(Scale-Down Model, SDM)?
前序文章《六步浅谈工艺表征的主要过程》中提到,FDA的工艺验证指南定义工艺表征为一个建立和获取工艺知识与理解的步骤。FDA的一个基本考虑点是生产企业可能尚不完全了解生产工艺的输入变异的全貌,因此需要设计实验来估计该变异性。[1]
可以使用质量风险管理的工具来筛选用于工艺表征研究的高风险工艺参数,具体操作可参考《工艺表征中的质量风险管理》。在生产规模上对风险评估筛选的工艺参数进行实验性研究是不切实际的,因此,监管机构推荐建立缩小模型来进行工艺表征研究。
【一】缩小模型和定义和法规要求
缩小模型,即工艺单元操作的实验室规模级别的操作模型,例如缩小的生物反应器,缩小的层析柱和超滤设备等。
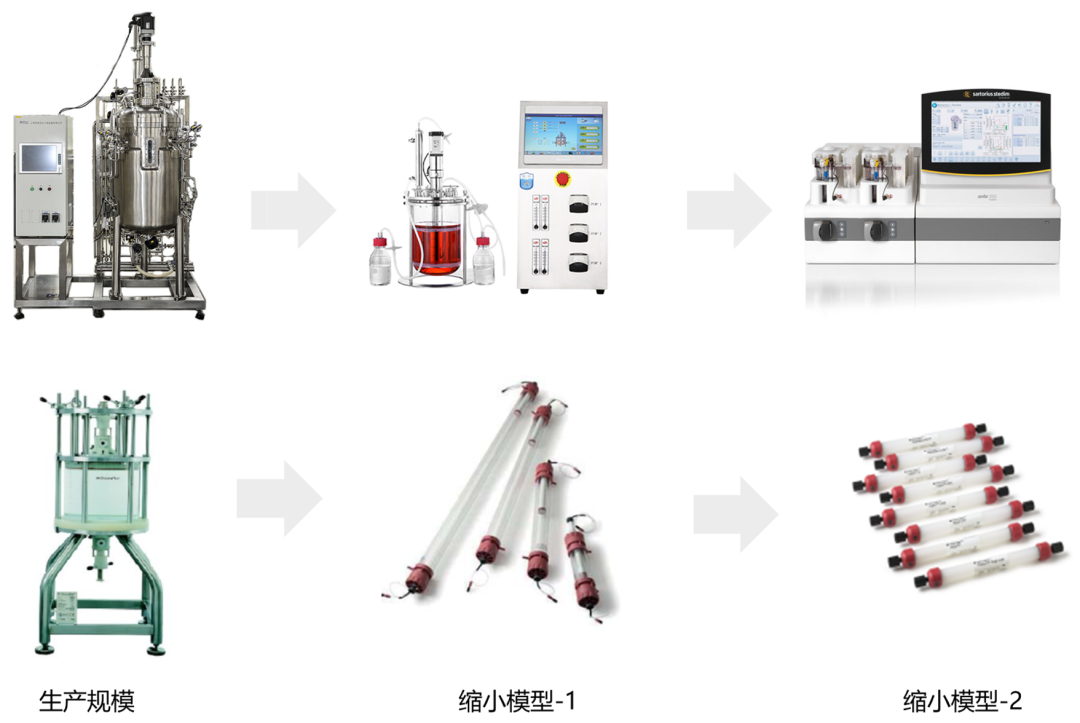
图1. 生物制药中的缩小模型示例
缩小模型在生物制药的生命周期内应用广泛,包括工艺开发、后期临床工艺开发、工艺表征、工艺验证,甚至上市后的商业化生产过程中都可能使用到缩小模型。
从监管的角度上讲,由于在缩小模型中得到的数据要为商业化生产提供支持和信息,所以对于工艺表征及其之后工艺验证、商业化生产上用到的缩小模型都是需要确认的,目的是证明缩小模型对商业化生产规模工艺的代表性。
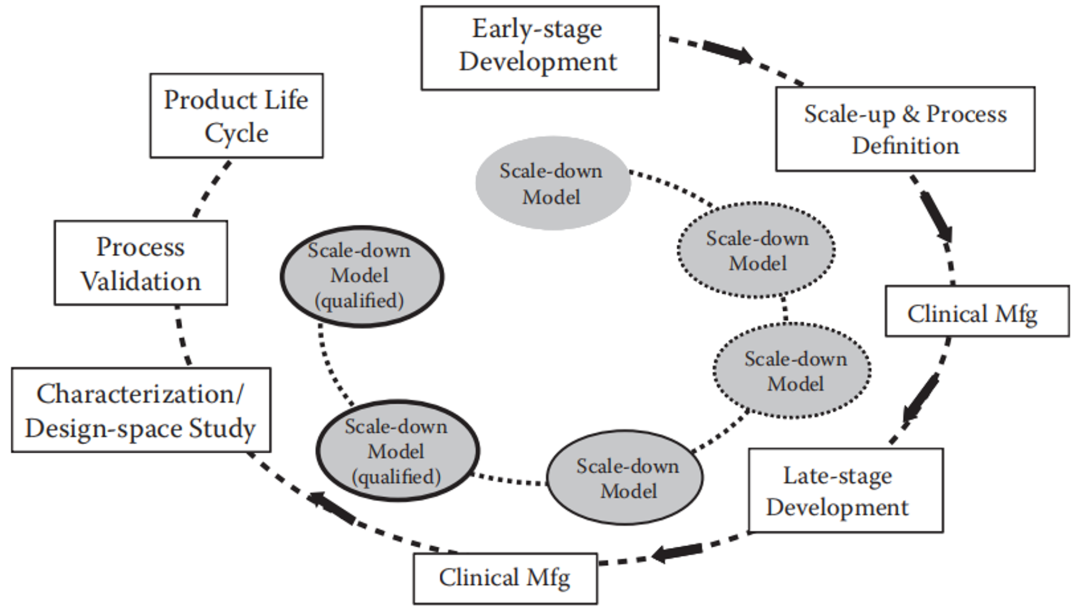
图2. 生物制药生命周期内的缩小模型[2]
工艺表征所用的缩小模型需要在正式的工艺表征实验研究之前建立完毕,并且最晚在上市申报前完成对商业化生产规模代表性的确认。
【二】缩小模型的建立
建立缩小模型,本质上是进行生产工艺规模的缩小,所用到的原则和方法与生产工艺规模的放大一致。
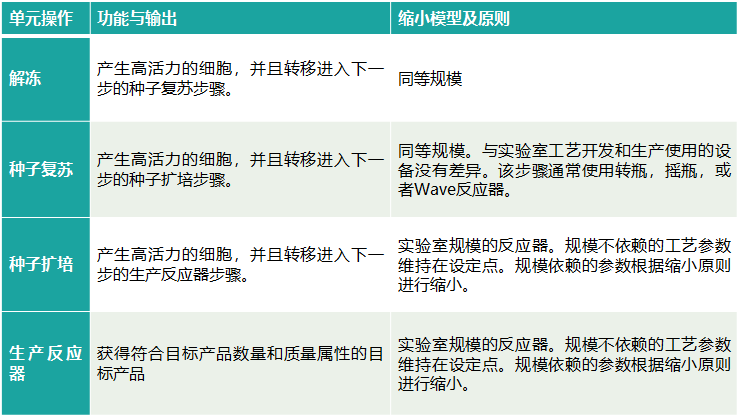
细胞培养工艺的缩小模型
细胞培养工艺的缩小模型通常使用2-10L的反应器来建立。
细胞培养工艺的缩小模型建立的原则:规模不依赖的工艺参数和操作与商业化生产规模保持一致;规模依赖的工艺参数和操作和按照一定的缩放原则进行缩小,如恒定P/V,恒定Kla原则等;
细胞培养工艺缩小模型与商业化生产规模工艺的确认主要是比较各种输出参数,比如生长曲线、表达滴度、生产速率、细胞密度和活力以及产品质量相关的属性(包括聚集体、片段、电荷异构体、糖型等)。
表1. 细胞培养工艺的缩小模型的建立[2]
层析纯化工艺的缩小模型
层析纯化工艺的缩小模型通常建立在0.5-1.6cm直径的层析柱上,通常缩小倍数为1000-10000倍。
层析纯化工艺的缩小模型采用线性缩小的原则来建立,即维持恒定的柱高和线性流速,维持恒定的单位体积介质的上样载量。其余的工艺参数则根据缩小比例进行线性缩小。
表2. 层析纯化工艺缩小模型建立的原则[3]
|
保持不变的参数 -- 柱高 -- 线性流速 -- 缓冲液体积/柱体积比值 -- 上样载量 -- 缓冲液pH、电导、配制方法 -- 来料上清的蛋白浓度及成分组成 -- 洗脱收集的收集标准 -- 操作温度 -- 层析介质 需要缩小的参数 -- 层析柱直径 -- 体积流速 -- 上样体积 需要注意的参数 -- 柱效 -- 柱壁效应 |
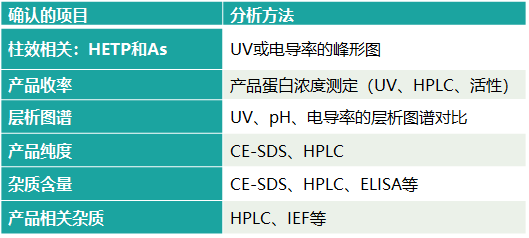
缩小模型与商业化生产规模工艺的确认需要对比各种输出参数,比如HETP和As,产品收率、层析图谱和产品质量相关属性(包括纯度、含量和相关杂质等)。
表3. 层析纯化工艺缩小模型的确认[2]
【三】缩小模型的确认方法
对于工艺表征和后续工艺验证所用的缩小模型需要进行确认,以验证缩小模型对商业化生产工艺的代表性,常用的方法主要是统计学方法,等价性检验和主成分分析是应用最多的两种。
等价检验
比较两组数据(缩小模型数据和生产规模数据)之间是否有显著性差异或者是否等价,标准T检验和等价检验是经典的统计学方法。对于缩小模型的确认,等价检验要比标准T检验更加合适。
等价检验是将缩小模型的数据与生产规模数据的差值与一个等价区间或无实际显著性差异的区间进行比较。统计学意义上的等价区间一般常选择生产规模数据的三倍标准差范围作为等价区间。通过计算两组数据的差值以及差值的90%置信区间,与等价区间进行比较来确定两组数据是否等价。
基因泰克发表的文献曾介绍了缩小模型确认的等价检验的不同结果,如下图。
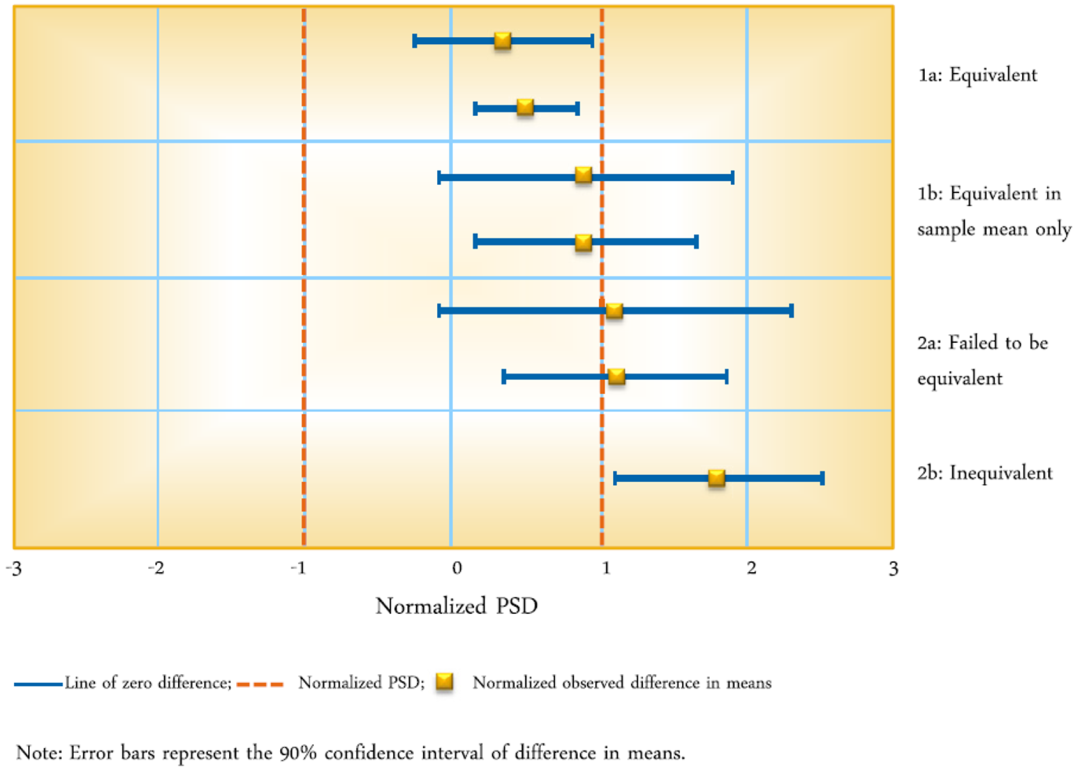
图3. 缩小模型确认的等价检验的可能结果示图[4]
基于上面展示的结果,我们对一个蛋白A亲和层析步骤的缩小模型与生产规模数据的等价检验进行分析,除了宿主细胞DNA和残留的蛋白A配基不等价之外,其他的质量属性上,该缩小模型与生产规模工艺都是等价的。
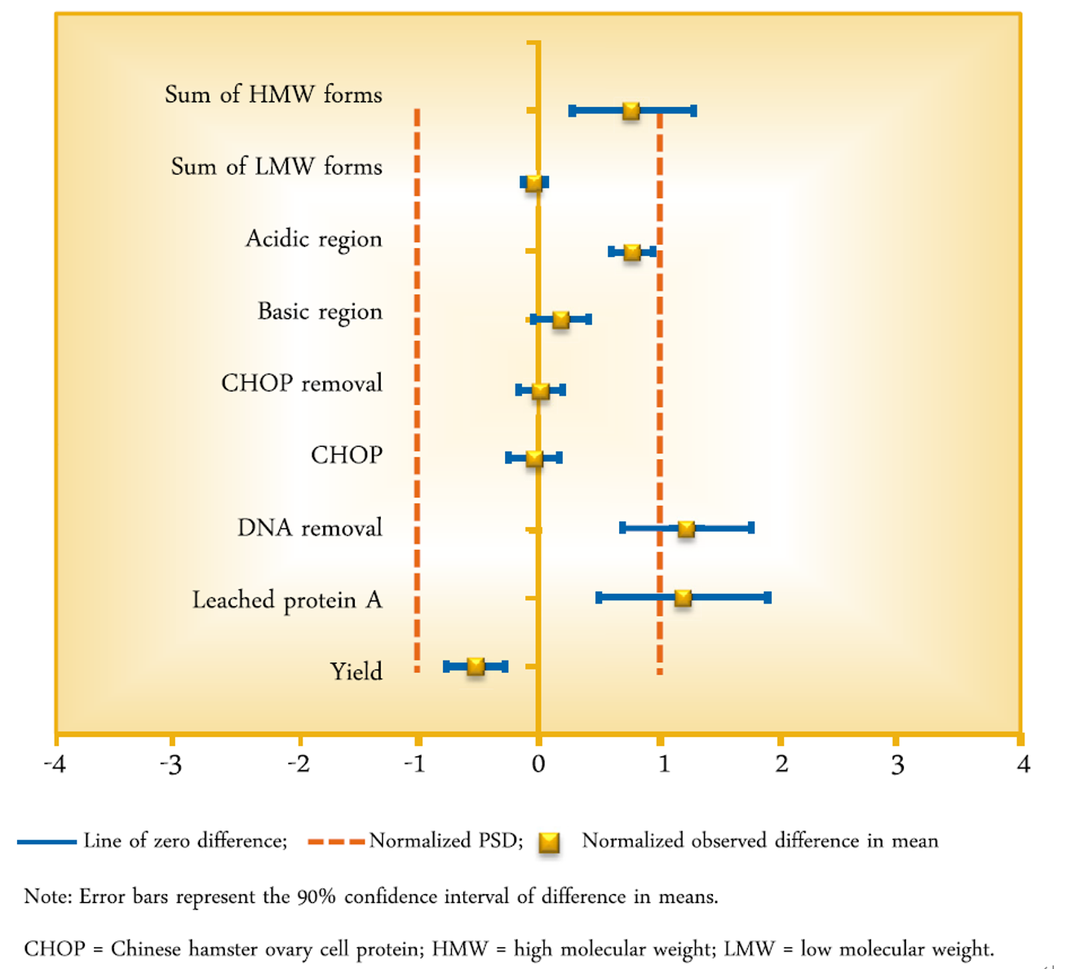
图4. 一个蛋白A亲和层析步骤的缩小模型的等价检验示例[4]
主成分分析
主成分分析能够把原来多个指标转化为少数的几个不相关的综合指标,同时对于多个指标还具有很强的代表性,从而实现数据的降维。主成分分析的方法通过对数据的重构来识别数据的底层结构,能够对多个变量进行研究,同时也能够识别出多元离群值。因此,借助主成分分析,可以在多个变量上一起对缩小模型和生产规模工艺的等价性进行比较,特别适合细胞培养过程这种工艺输入和过程参数数据量丰富的工艺步骤。
一个细胞培养的案例中,使用主成分分析的变量包括:
表4. 细胞培养步骤中可用于主成分分析的变量示意[2]

基于恒定Kla原则建立的5L规模缩小模型与生产工艺规模的主成分分析,得分图显示两个规模在所分析的上述变量上具有等价的结果,即不存在显著的差异,从而可以得出结论,即该缩小模型能够代表商业化的生产规模工艺。
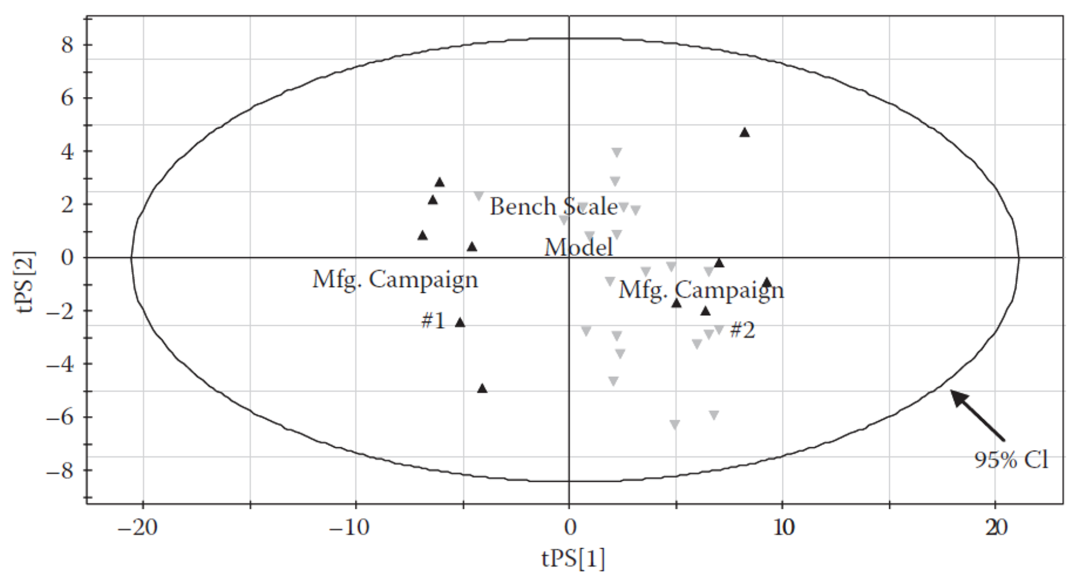
图5. 一个细胞培养步骤的主成分分析的案例[2]
实际生产工艺上比较活细胞密度和表达滴度也显示出了一致性,与统计学比较的结果一致。
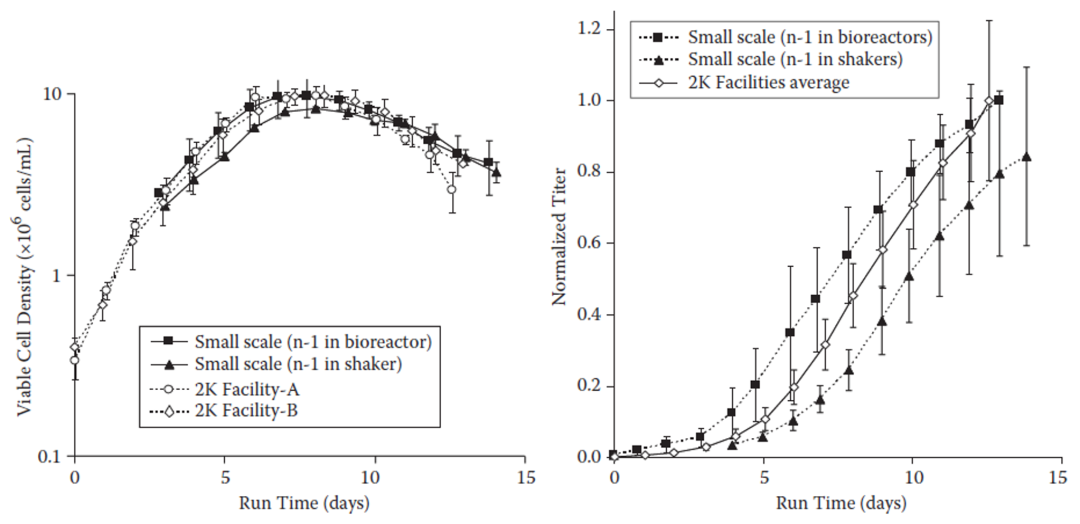
图6. 活细胞密度与表达滴度的缩小模型与生产规模比较[2]
总结基于风险评估筛选出来的高风险工艺参数需要在缩小模型上进行工艺表征研究。监管机构的法规指南对缩小模型的唯一要求是要求缩小模型能够代表商业化生产规模工艺的性能。因此,按照一定的原则建立缩小模型并进行统计学方法的确认是工艺表征中必不可少的步骤。本文的介绍能够作为实际工艺表征工作中建立和确认缩小模型的指导和参考。康日百奥作为一站式生物药CDMO服务商,提供从细胞株构建、细胞培养工艺开发、分析方法开发、制剂处方开发、纯化工艺开发、工艺表征、工艺验证以及原液和成品的cGMP生产。康日百奥搭建有完整的工艺表征技术平台,针对市场主流的商业化规模反应器系统建立了相应的缩小模型,可针对影响产品关键质量属性的中高风险参数进行多变量实验设计,基于关键质量属性的识别,为商业化规模生产工艺参数确定了科学合理的参数范围,用于支持后续的工艺验证环节和药品上市申报。同时,根据不同合作伙伴项目的独特性,制定相应的技术转移、工艺开发、工艺表征及放大生产方案。
康日百奥作为一家专业的生物药CDMO服务供应商,拥有强大的工艺开发团队,在工艺表征和工艺验证的项目上都拥有丰富的知识积累及充足的实战经验,保证客户项目的顺利交付。团队成员已经帮助多家国内外知名公司成功转移、放大和生产2000L的临床和商业化产品,同时具有丰富的药品申报上市经验,其中包含多批具有较高技术难度,从3L直接放大至2000L的生产项目,成功率100%。
参考文献
1.FDA Guidance for Industry:Process Validation: General Principles and Practices, 2011年
2.Anurag S. Rathore, Gail Sofer,Process Validation in Manufacturing of Biopharmaceuticals,Third Edition
3.Cytiva,生物工艺放大解决方案
4.Christian Hakemeyer, et al,Process Characterization and Design Space Definition. Biologicals 44(2016) 306-318
















