Bio-Share | 六步浅谈工艺表征主要过程
发布时间: Aug 22 , 2022
何为工艺表征(Process Characterization)?
根据FDA的工艺验证指南,工艺表征设定为一个建立和获取工艺知识与理解的步骤。FDA的一个基本考虑点是生产企业可能尚不完全了解生产工艺的输入变异的全貌,因此需要设计实验来估计该变异性。[1]
PDA技术报告60曾定义工艺表征为利用风险评估和实验性研究来确定工艺操作参数对产品质量属性和工艺性能影响的一系列记录在案的研究。[2]
近年来,工艺表征逐步成为工艺验证的非常重要一环,也是向监管机构展示生产企业对生产工艺的理解和认知的重要步骤。工艺表征相关内容也是项目监管申报的CTD资料的3.2.S.2.5工艺验证/评价中需要体现的内容。
工艺表征的基本六步
可是,该如何正确的准备和完成工艺表征研究呢?
基于法规理解、行业实践及生物工艺的可操作性,一个完整和成功的工艺表征研究需要整合和完成以下六步的任务内容:
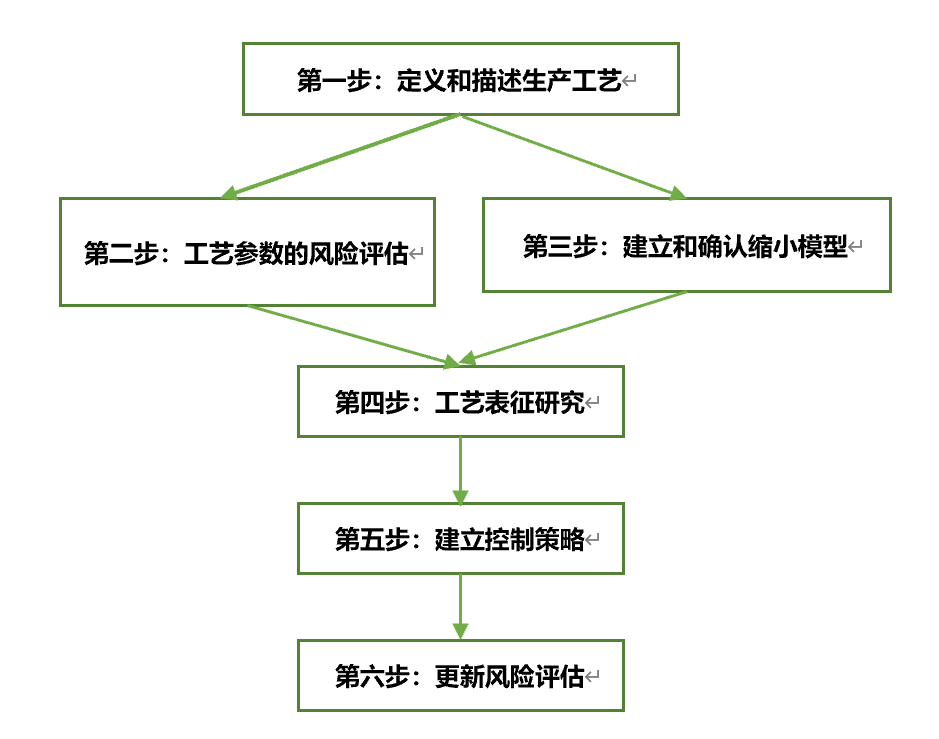
第一步 定义和描述生产工艺
生产工艺是在工艺开发过程中定义的,在工艺表征之前,需要详细的描述生产工艺,包括单元操作,工艺输入和输出,可以使用工艺流程图的形式。
为进行后续的工艺表征,在生产工艺的描述中需要明确单元操作与工艺输出之间的关系,即是说每个单元操作与其所影响的工艺输出之间的关系,可以使用因果分析的方法。
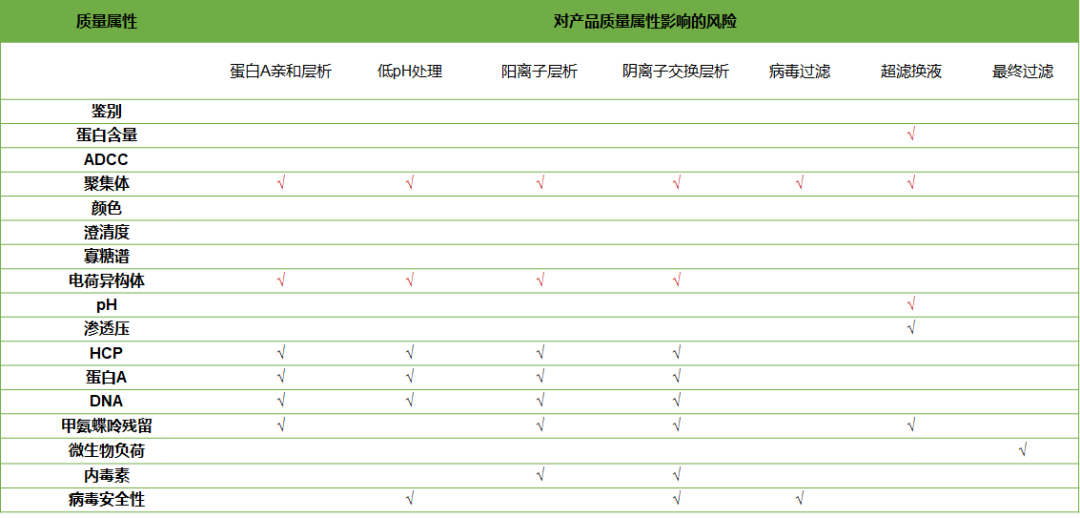
图1:单元操作与产品质量属性的因果关系[3]
第二步 工艺参数的风险评估
FDA的工艺验证指南指出,因为不可能对所有的工艺参数进行实验性研究,因此需要使用一定的工具来筛选出高风险的工艺参数,即对工艺性能和产品质量属性影响风险比较高的工艺参数。常使用的工具即是风险评估的工具,比如因果效应矩阵(C&E)、失败模式与效应分析(FMEA)以及风险排序与过滤(RRF)等。
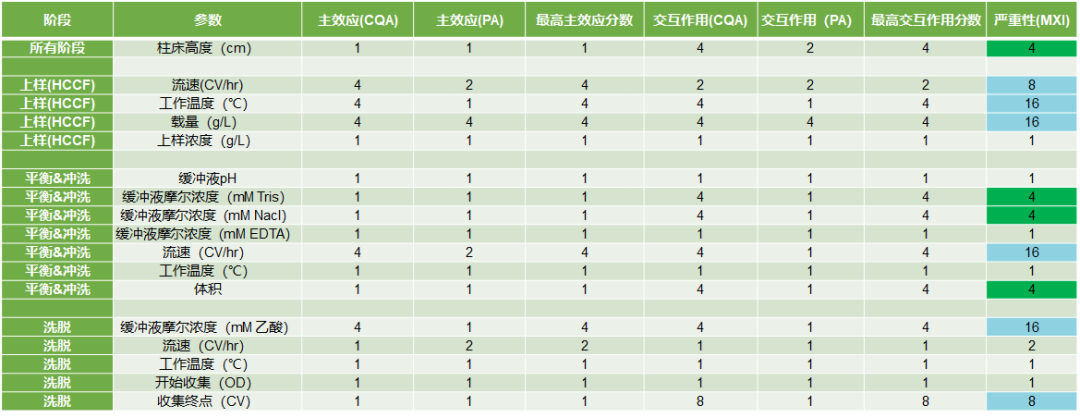
图2:蛋白A层析步骤的工艺参数风险评估[3]
通过风险评估工具筛选出的高风险工艺参数即会进入后续的工艺表征研究。
第三步 建立和确认缩小模型
FDA的工艺验证指南同时指出,因为不可能在生产规模上对工艺参数进行研究性工作,因此需要设计实验室规模的模型,即缩小模型。
法规指南对缩小模型的唯一要求是,缩小模型需要能够代表商业化生产工艺,即需要对缩小模型进行确认。此时,常使用统计学的工具,比如等价检验、主成分分析等。
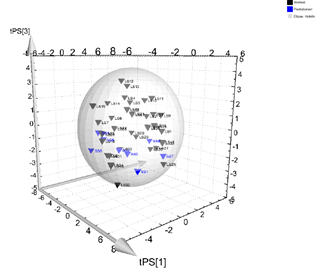
图3:使用主成分分析确认缩小模型与商业化生产工艺[3]
第四步 工艺表征研究
在缩小模型上设计实验以研究高风险的工艺参数对工艺性能和产品质量的影响,使用单因素实验或者实验设计(DoE)的方法。
实验设计是监管机构鼓励采用的方法,因为实验设计可以研究到工艺参数之间的交互效应和二次项效应,能够更准确的描述输入和输出之间的关系。
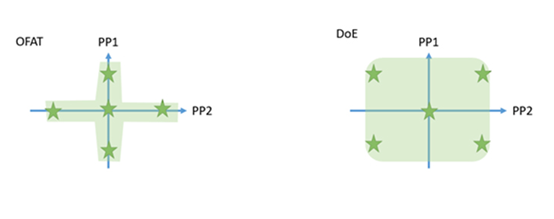
图4:单因素实验(OFAT)和实验设计(DoE)
除此之外,工艺表征研究还需要考虑到杂质清除的研究(包括挑战性实验),关键原材料的研究以及单元操作之间的链接研究。
第五步 建立控制策略
通过工艺表征研究需要确定关键质量属性和关键工艺参数的列表,以及关键质量属性的可接受范围与关键工艺参数的设计空间。
关键质量属性通常需要各种分析检测来控制,比如工艺中控、放行检测、稳定性检测、表征和可比性检测等。关键工艺参数的控制则是通过工艺程序和操作规程控制,保证其在设计空间内。
基因泰克曾介绍了其控制策略建立和选择的工具:风险排序和过滤(RRF)。
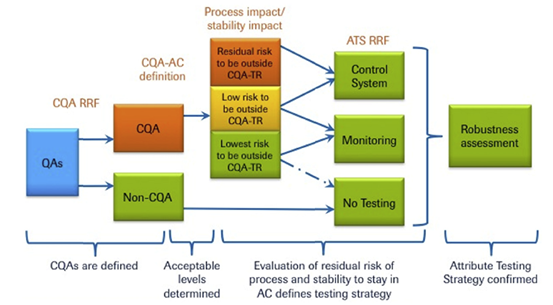
图5:建立工艺控制策略的案例[4]
第六步 更新风险评估
结合工艺表征研究的数据再次进行风险评估,同时更新风险评估的结果。更新的风险评估和工艺表征研究的结果用于确定最终的关键质量属性和关键工艺参数列表,并为后续的工艺性能确认(PPQ)做好准备。
总结
工艺表征的目的是建立和获取工艺知识与理解,需要使用风险评估、实验设计等工具。本文介绍了工艺表征的六步法,可以系统、完整的完成工艺表征研究,为工艺验证和后续的注册申请打下基础。
细数国内拥有工艺开发服务的CDMO公司,康日百奥建立了一套完整的方法流程,基于工艺参数的风险评估、缩小模型的建立和确认、工艺表征实验、控制策略的建立和风险评估更新等一系列工艺表征步骤,制定了完整的工艺控制策略,并可应用到商业化生产过程中。康日百奥搭建有完整的工艺表征技术平台,针对市场主流的商业化规模反应器系统建立了相应的缩小模型,可针对影响产品关键质量属性的中高风险参数进行多变量实验设计,基于关键质量属性的识别,为商业化规模生产工艺参数确定了科学合理的参数范围,用于支持后续的工艺验证环节和药品上市申报。同时,根据不同合作伙伴项目的独特性,制定相应的技术转移、工艺开发、工艺表征及放大生产方案。
康日百奥作为一家专业的生物药CDMO服务供应商,拥有强大的工艺开发团队,在工艺表征和工艺验证的项目上都拥有丰富的知识积累及充足的实战经验,保证客户项目的顺利交付。团队成员已经帮助多家国内外知名公司成功转移、放大和生产2000L的临床和商业化产品,同时具有丰富的药品申报上市经验,其中包含多批具有较高技术难度,从3L直接放大至2000L的生产项目,成功率100%。

康日百奥优越的生产工艺把控能力及高速的规模化产能扩展,有能力向全球合作伙伴提供符合国际标准的临床样品制备及商业化生产服务。
康日百奥拥有成品(DP, Drug Product)灌装生产线,可提供无菌商业化西林瓶冻干,无菌预充针、卡式瓶灌装服务,累计成品灌装产能达到1500万支/年,可完全灵活满足合作伙伴对于不同工艺,不同类型制剂产线的灌装量日益增长的需求。完全实现大规模原液(DS, Drug Substance)和成品GMP生产的紧密结合。康日百奥可提供西林瓶(水针+冻干) 预充针 卡式瓶无菌灌装服务。
参考文献
1. FDA Guidance for Industry:Process Validation: General Principles and Practices, 2011年
2. PDA Technical Report NO 60:Process Validation: A Lifecycle Approach, 2013年
3. CMC Biotech Working Group, A-Mab, a Case Study in Bioprocess Development. 2009年
4. J. Felix Kepert et al, Establishing a control system using QbD principles, Biologicals 44 (2016) 319e331
















