Bio-Share PC&PV | QbD理念在分析方法开发上的应用
发布时间: Nov 27 , 2023
01
分析质量源于设计(AQbD)的由来
为能够提供具有一定质量、安全和有效的药物,质量源于设计(QbD)作为一个整体和系统的方法开始在制药开发中流行。QbD强调将质量“构建”到产品或工艺中,而不仅仅是基于定期的“检验和测试”。[1]
分析方法是制药开发的一个不可或缺的阶段。分析方法的每个阶段,包括分析方法开发、验证和转移,都涉及高度的可变性,而传统的分析方法开发方法,比如单因子方法,非常的繁琐,且效率低下。[2]
药物分析专家考虑将QbD的优势扩展到分析方法开发,因此推动了分析质量源于设计(AQbD)的进展。与 QbD 非常相似,AQbD 也是一种基于科学和风险的分析方法开发模式,努力实现预定义的目标,以增强分析方法性能、稳健性、耐用性和灵活性,以实现持续改进。[2]
AQbD 的这种整体策略提供了一个突出优势,即能够准确描述或预测分析过程的性能、药物的准确量化以及估计多个分析方法变量之间可能的协同作用或拮抗作用,因此,也可节省很多有形的资源。
 图1:AQbD倾向于节省有形资源[3]
图1:AQbD倾向于节省有形资源[3]
02
AQbD的策略原则和执行步骤
AQbD 在分析中的实施过程与产品 QbD 非常相似。总的来说,AQbD的实施可以通过五个关键步骤成功完成,这些步骤将在下面进行详细的描述。
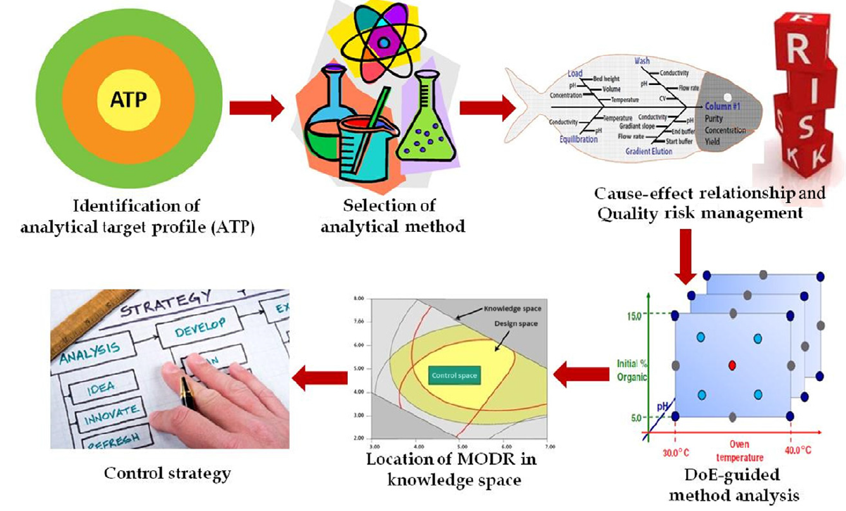 图2:AQbD实施的五个步骤[3]
图2:AQbD实施的五个步骤[3]
步骤1:建立分析目标概况(ATP)
基于 QbD 原则开发的任何分析方法的基础是 ATP,它与在药品中实施QbD时的目标产品质量概况非常相似。ATP包含分析方法和质量要求的目标,以便对材料属性得出可预测的结论。
步骤2:识别关键分析属性(CAA)和关键方法变量(CMV)
关键分析属性(CAA)是指分析方法分析材料属性时,衡量分析方法能力的一些属性指标,比如液相色谱分析方法的CAA常包括峰面积、保留时间、相对保留时间、分辨率、不对称因子、理论塔板数等。
关键方法变量(CMP)是与仪器设置参数、色谱柱化学和尺寸、样品制备等相关的重要输入因子或自变量。除了先前文献之外,分析科学家的过程知识和经验也被认为是确定 CMP 的关键。
识别影响CAA的CMV时,通常使用质量风险管理的工具,比如鱼骨图,风险评估矩阵或失败模式与效应分析(FMEA)方法。[3]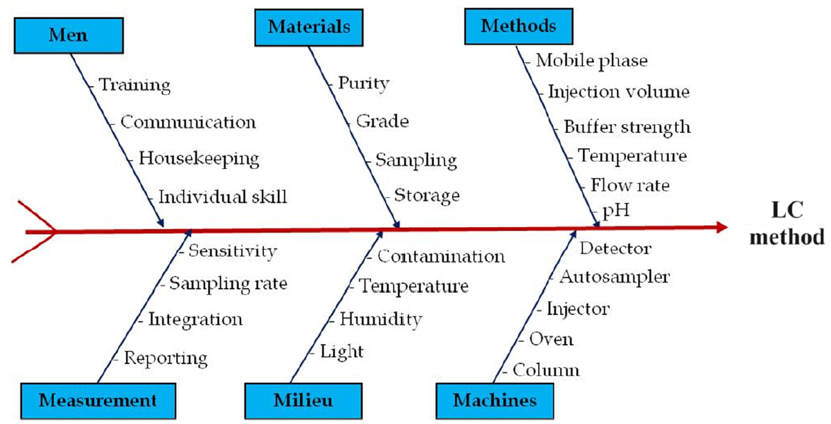 图3:液相色谱分析方法的鱼骨图分析
图3:液相色谱分析方法的鱼骨图分析
步骤3:基于DoE的分析方法开发
应用DoE 原则有助于科学地理解多种分析方法参数和变量,这些参数和变量往往会影响 CAA,使用最少的实验来产生最大的信息,同时可以揭示(任何)相互作用的普遍性并减少复杂性。
在基于 DoE 的数据分析过程中,实验设计是必不可少的。一阶筛选设计有助于在可靠的统计分析的基础上识别高风险因子。此类筛选设计的实例包括部分析因设计、田口设计和 Plackett-Burman 设计。响应面设计有助于分析方法的系统开发,特别是涉及 CMP 和 CAA 之间的显著非线性和/或相互作用。此类优化设计的实例包括完全析因设计、中心复合设计、Box Behnken 设计、最优设计、Doehlert设计等。各种 3D 响应曲面和 2D 图形,例如等高线图、线性相关图、异常值图和 Box Cox 图构成了一些重要的图形工具。
根据所选设计收集数据后,可以使用多元线性回归分析等统计分析方法或人工神经网络等数学模式对结果进行分析,以得出客观结论。最后,采用适当的数值(如意愿函数)和图形优化(如叠加图)技术进行最优搜索。
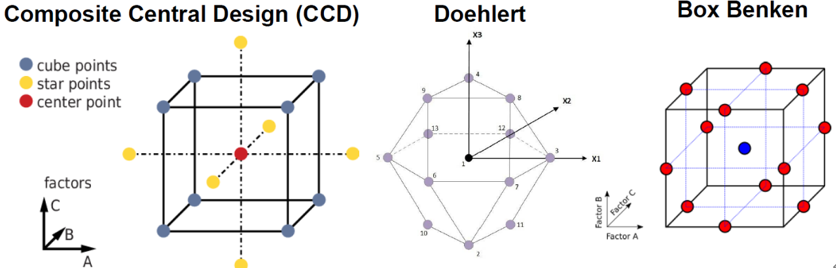 图4:优化设计常用的几种实验设计示意图[3]
图4:优化设计常用的几种实验设计示意图[3]
步骤4:建立分析方法可操作设计空间(MODR)
分析方法的 MODR,也称为“已证实的可接受范围 (PAR)”,是经证明的可提供质量保证的输入变量(即分析过程中的 CMP)的多维组合和相互作用。完成 DoE 指导的分析方法开发和实验数据分析后,随后确定设计空间区域以着手制定最佳解决方案。
在实验设计、叠加绘图和/或意愿函数的数值技术的帮助下建立 MODR 后,最终验证它确定的“失败边缘”,这可能会在以后规避分析方法失败的任何可能性。在 MODR 中,很多时候,理想的做法是在其中确定一个区域来设置内部范围,也称为正常操作范围 (NOR) 或分析控制空间。
从监管的角度来看,在 MODR 内工作不被视为一种变更,并且分析方法可以被认为足够稳健,可以使用。这对分析方法转移过程中提供了更大的灵活性和影响力。通常,MODR 由申请人提出,并在必要的监管评估和批准后获得批准。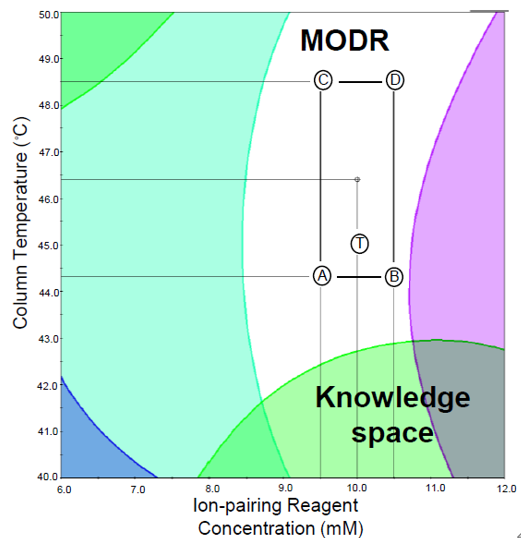
图5:AQbD中的MODR示意图;其中ABCD组成的区域为NOR区域,四个点可作为模型验证的点[3]
步骤5:控制策略与持续改进
针对所有可能变异的计划控制策略可确保在分析方法转移和常规使用期间满足 ATP 要求。这可以通过连续监测 CAA 或系统适用性参数来实现。
控制策略并不总是一次性的,应该在分析方法开发生命周期的所有关键阶段制定,以便持续改进。即使执行了AQbD,分析方法验证、确认和转移也是确保分析方法适合其预期用途的重要工作。
03
AQbD的监管观点
为了确保分析系统和相关分析方法的持续性能,US-FDA 和 USP 强制要求为分析方法建立系统适用性测试。然而,USP-NF 和欧洲药典的最新更新允许在无需重新验证的情况下灵活地变更分析方法,前提是 AQbD 分析方法本身已经实施。
FDA 2015 年 7 月的行业指南:“药物和生物制品的分析程序和分析方法验证”涵盖了分析方法开发的重要方面,其中包括在 DoE 和多变量测试的帮助下对分析方法稳健性的关键评估,从而实现增强的性能。[4]
ICH Q14“分析程序开发”以及对“分析程序验证:文本和分析方法论”的 ICH Q2(R1) 指南的修订,推荐符合规定的 ATP 要求的分析方法验证标准。通过分析方法开发,可以了解影响 ATP 的分析方法属性。[5]
基于现有的法规指南显示,AQbD 的实施预计将加强“在正确的时间进行正确的分析”的概念,在药品开发中显现出巨大的潜力。
参考文献
[1] Singh B, Beg S. Attaining product development excellence and federal compliance employing quality by design (QbD) paradigms. Pharma Rev 2015;13(9):3544.
[2] Singh B, Khurana RK, Kaur R, Beg S. Quality by design (QbD) paradigms for robust analytical method development. Pharma Rev 2016;14(10):616.
[3] Sarwar Beg, Md Saquib Hasnain Handbook of Analytical Quality by Design Elsevier
[4]https://www.fda.gov/regulatory-information/search-fda-guidance-cuments/analyticalprocedures-and-methods-validation-drugs-and-biologics..
[5]https://database.ich.org/sites/default/files/Q2R2-Q14_EWG_Concept_Paper.pdf..
关于康日百奥
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)
















