Bio Share PC&PV | BLA申报的一次性使用系统的相容性研究要求
发布时间: Apr 23 , 2024
一次性使用系统(single use system,SUS) 是一种工艺设备解决方案,通常由聚合材料组件装配而成,形成一个系统或单元操作,用于单次或一个阶段性制药生产活动。一次性使用产品一般是由塑料制成,包括聚酰胺、聚碳酸酯、聚乙烯、聚醚砜等材质[1]
一次性使用系统的应用和发展
随着制药工艺设备和一次性使用技术的快速发展和成熟,SUS在制药领域,以及药品生产的各个环节开始广泛使用,比如细胞培养/ 发酵、培养基制备、病毒灭活、蛋白纯化、除菌过滤、缓冲液配制、原液保存、中间体保存和转移、工艺过程中的取样、制剂配制、制剂灌装、原液和制剂冻融等生产工艺。
SUS占地面积小、污染风险低、无需在线清洁和在线消毒、操作简单、生产工艺转换灵活等优点,可以大大缩短药品的研发周期,加快药品的上市进度。
一次性使用系统的法规要求
尽管SUS具有很多潜在优势,但是在药品生产的实际使用过程中,SUS与工艺流体的接触有可能导致潜在的化合物从SUS组件的接触面浸出并进入工艺流体中,从而对药品质量和安全性产生负面影响。由于浸出物而导致的药品召回事件也时有发生。
2020年,NMPA发布了《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)》,要求对注射剂生产过程中使用的塑料组件系统开展相容性研究,并指出塑料组件系统的相容性风险通常来源于与液体接触后产生的相关浸出物[2]。
美国药典协会在2020年更新了USP<665>和<1665>章节,详细描述了化药和生物药生产过程中使用的塑料组件系统的可提取物和浸出物(E&L)研究思路[3,4]。
BPOG行业协会在2014年和2017年发表的一次性组件的E&L研究和评估策略,为一次性产品生产企业和生物制药企业提供了可参考的行业解决方案[5]。
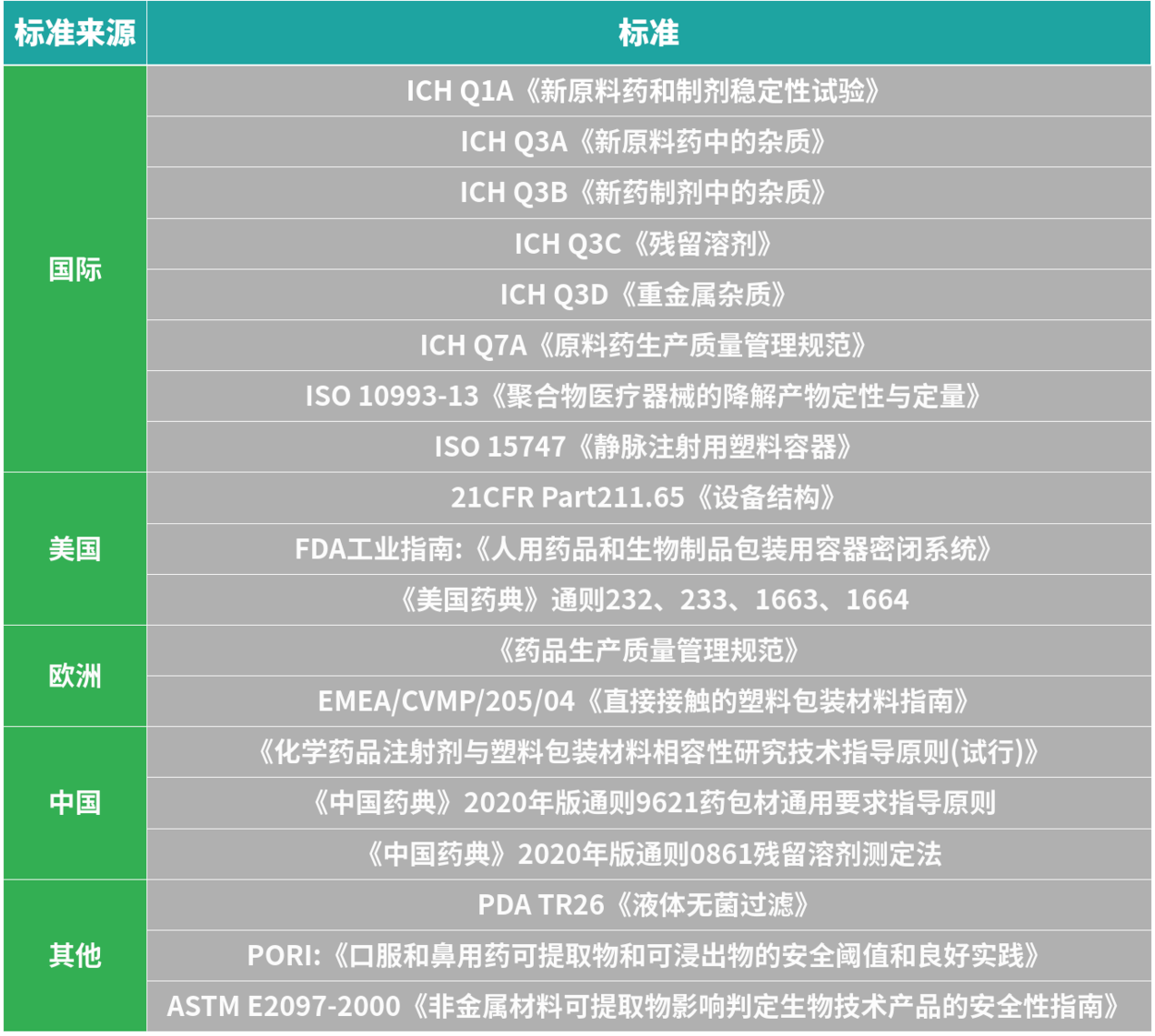
下表是关于SUS相容性研究相关的法规指南文件总结。
表1:SUS 相容性研究相关技术文件[1]
SUS相容性研究
相容性研究通常是证明器具、包装系统与药品之间没有发生严重的相互作用,并导致器具、包装系统和药品质量发生改变,以及产生安全性风险的过程。相容性研究是始于药品研发初期,并贯穿于药品研发及上市整个生命周期。
相容性研究主要包含两方面的思考,一是系统对药品的影响,比如从系统进入药品中的浸出物或迁移物,以及系统对药品活性成分或功能性辅料的吸附;二是药品对系统的影响,比如因与药品的接触,系统发生侵蚀或变形,从而影响系统的保护性或密封性。
对SUS相容性评估中,最为关注的是可提取物和浸出物评估。
什么是可提取物和浸出物(E&L)?
可提取物(Extractable)是在极端条件下(例如有机溶剂,极端温度,离子强度,pH,接触时间等),可以从组件材料的工艺介质接触表面提取出的化学物质。浸出物(Leachable)在典型工艺条件下,从接触产品或非接触产品的材料中浸出,并在最终药品中检测出的化学物质[5]。
可提取物在数量和含量上一般都远大于浸出物的,因此通常会认为浸出物是可提取物的一个子集,或可提取物可代表浸出物研究的最差条件。
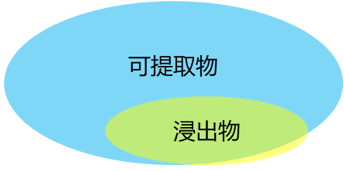
图1:可提取物与浸出物关系
可提取物通常由SUS供应商进行研究,而浸出物的研究则通常需要药品生产企业与SUS供应商共同进行。
E&L研究思路
E&L研究,尽管可以参考药包材的相容性研究要求,但是基于法规监管要求的对比,药包材和SUS的相容性研究还是有差异的。药包材是法规监管机构关注的重点,需要强制执行浸出物的研究,并且要考虑多个制剂批次(比如三批)以及多个稳定性时间点的浸出物检测。
SUS考虑的主要是对工艺性能和产品质量的影响,浸出物的研究不是强制项,如果具有足够的可提取物数据和风险评估,也可以满足BLA申报要求。
基于此,BPOG和CBER给出了类似的E&L研究建议:
- 进行风险评估,确定SUS的风险大小;
- 可提取物数据的合理使用,基于风险评估的结果,没有风险或中低风险的SUS,“可交叉应用供应商数据并提交数据适用性说明以及不需要额外测试的理由”;高风险的SUS,可基于可提取物数据进行毒性判断;
- 浸出物研究,如果高风险SUS的可提取物数据的毒性判断不可接受,则需要进行浸出物研究,基于浸出物数据来评估对工艺性能和产品质量的影响。
E&L研究的风险评估
BPOG在2017年的《Best Practices Guide for Evaluating Leachables Risk from Polymeric SUS Used in Biopharmaceutical Manufacturing》中给出了一个对SUS进行风险评估的解决方案。
该风险评估从五个维度上对SUS进行评估,包括SUS在产品工艺中的位置(DAS)、暴露温度(ET)、暴露时间(ED)、与工艺流体的相互作用(PFI)和稀释比(DR),并且每个维度给予了不同的权重。
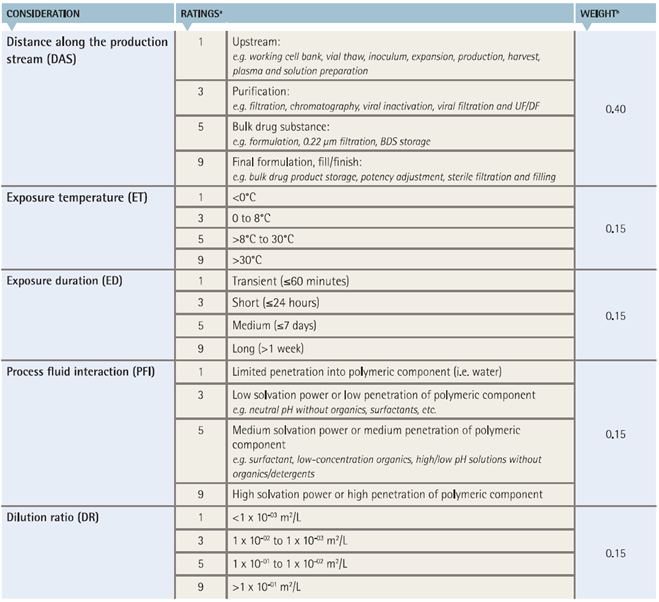
图2:SUS风险评估的评分表[5]
最终风险分数的计算是:风险分数=DAS*0.4 + ET*0.15 +ED*0.15 + PFI*0.15 + DR*0.15。因此风险分数的范围为1.0-9.0。
基于风险分数可将SUS系统划分为三个不同风险等级,并对其具有不同要求。
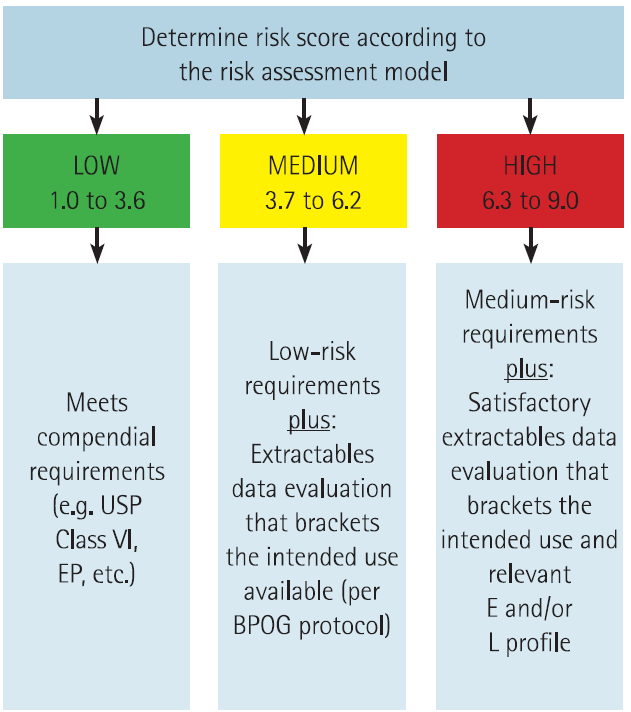
图3:SUS的风险等级划分及相应要求[5]
低风险SUS(1.0-3.6)需要符合USP要求,并且要求供应商按照药典标准进行相应检测。中风险SUS(3.7-6.2)需要达到低风险SUS的要求,并且同时要求提供可提取物数据。高风险SUS(6.3-9.0)需要达到中风险SUS的要求,同时需要对可提取物数据进行毒性判断,或者提供浸出物数据。
可提取物数据的合理使用
通常SUS供应商会提供一份可提取物指南或数据,药品生产企业可以合理的使用这些数据来确定SUS的可接受性。
对于高风险SUS的可提取物数据,如果是已知化合物,可以根据重复剂量研究和/或生殖毒性研究的数据计算其每日允许暴露量(PDE),以确定病人暴露在该可提取物数据条件下是否具有安全性风险。
对于未知化合物,则可使用安全性关注阈值评估(STC)来评估;对于没有毒性数据或毒性数据有限的非高致癌化合物,也可采用毒理学关注阈值(TTC)进行评估。
如果可提取物的毒理学判断对患者安全构成可接受的风险,则不需要进一步的浸出物研究,并且可提取物数据可以用作组件确认资料包的一部分。然而,如果毒理学特征对患者安全存在风险,则可能认为有必要进行浸出物研究。
浸出物研究
应使用实际工艺流体进行浸出物测试。不过,在某些情况下,也可能会使用替代液或需要开发特定的分析方法来减轻分析干扰,比如来自蛋白质信号的干扰。
浸出物研究中使用的参数应支持潜在的生产工艺和储存条件,以确保所得浸出物数据能够代表与 SUS 接触后工艺流体中可能存在的浸出物。浸出物研究考虑的主要参数包括阴性对照溶液、样品处理、接触流体、灭菌处理条件、样品体积、接触时间、温度、分析检测方法等。
由于干扰信号的存在,灵敏的分析方法是浸出物研究的重要部分。可以根据其对所讨论的化合物和基质的适用性选择更全面的分析技术,例如顶空 [HS]/气相色谱 [GC]/质谱 [MS]、GC/MS、液相色谱 [LC]/MS 或 LC/UV、电感耦合等离子体质谱 [ICP MS]、电感耦合等离子体光学发射光谱 [ICP OES] 和电感耦合等离子体原子吸收光谱 [ICP-AAS]等。
浸出物数据还需要完成浸出物安全风险评估。如果浸出物的毒理学判断被认为对患者安全构成可接受的风险,则浸出物数据可用作确认资料包的一部分。然而,如果浸出物的毒理学判断对患者安全造成不可接受的风险,则可以使用替代聚合物成分(即必须考虑风险较低的材料变化或非聚合物成分。或者,如果可行,可以修改工艺条件以降低风险状况。
E&L研究决策树
BOPG最后总结了SUS系统的E&L研究决策树,该决策树即可指导BLA中对SUS的E&L研究,提供合理的依据。
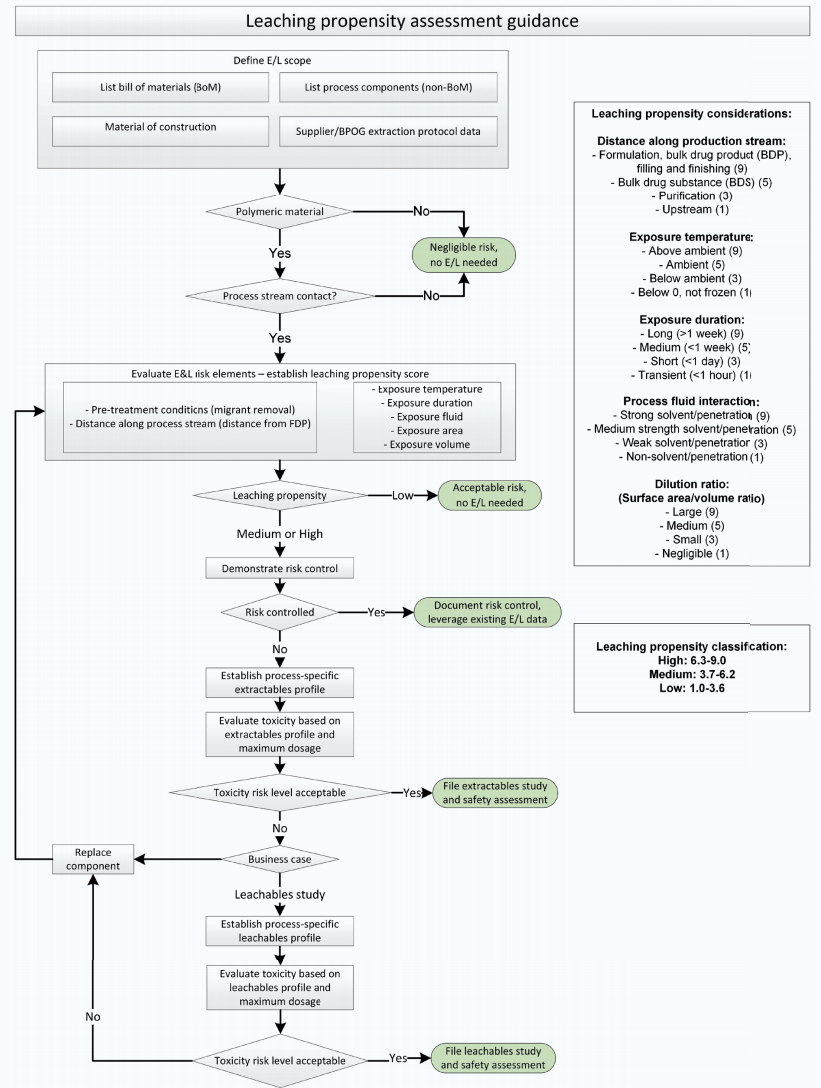
图4:SUS的E&L研究决策树[5]
总结
SUS作为一种行业解决方案在生物制药过程中使用越来越广泛,相应的,关于SUS的验证和相容性研究也开始成为监管的关注点和BLA申报要求。本篇微文介绍了SUS相容性研究的策略,主要是监管重点关注的E&L研究,这也是行业目前通用的策略。基于该策略的SUS相容性研究可满足BLA申报的要求,保证药品上市的需求。
参考文献
1. 洪小栩 药品生产用一次性使用系统风险管控的思考 中国食品药品监管 2022年第 2期(总第 217期)
2. NMPA 2020.06.02 《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(征求意见稿)》
3. USP <665> Polymeric components and systems used in the manufacturing of pharmaceutical and biopharmaceutical drugs products
4. USP <1665> Polymeric components and systems Used to Manufacture Pharmaceutical Drug Products.
5. BPOG Best Practices Guide for Evaluating Leachables Risk from Polymeric SUS Used in Biopharmaceutical Mamufacturing. 2017
关于康日百奥Bioworkshops
康日百奥Bioworkshops是一家专业的生物药CDMO,位于苏州工业园区东旺路5号。公司服务范围包括生物药工艺开发、cGMP原液生产、无菌制剂灌装等。团队成员均为经验丰富的生物制药行业资深人士,对生物药CMC领域有着深刻的理解。康日百奥Bioworkshops原液产能13000L,同时拥有包含西林瓶水针,冻干、卡式瓶、预充针、注射笔等的无菌制剂灌装服务,可完全实现从早期临床前样品生产至商业化生产的高效衔接。
康日百奥Bioworkshops已成功帮助多个合作伙伴的单抗、双抗、多抗、ADC、融合蛋白、细胞因子等项目获得中国、美国、澳大利亚等的临床批件。
康日百奥Bioworkshops致力于为全球合作伙伴提供高效、高质量的生物药外包服务解决方案,帮助合作伙伴缩短药物进入临床试验和上市的时间。
公司业务范围:
细胞株构建 | 细胞培养 | 纯化工艺开发 | 制剂处方开发 | 分析方法开发 | 工艺表征工艺验证 | 原液和成品的cGMP生产(200L、500L、2000L) | 无菌灌装(预充针、卡式瓶、注射笔、西林瓶水针、冻干)

















